摘要:研究人員發現靶向組蛋白伴侶NASP可增強PARPi敏感性。
PARP抑制劑(PARPi)在治療同源重組缺陷腫瘤中取得重大突破,但耐藥性仍是臨床挑戰。研究人員發現PARPi會觸發癌細胞染色質組蛋白釋放,而靶向組蛋白伴侶NASP可增強PARPi敏感性。該研究揭示了NASP通過TPR結構域維持組蛋白穩定性,與INO80復合物及PARP1協同調控組蛋白周轉,為克服PARPi耐藥提供了新靶點。
這項突破性研究揭示了聚(ADP-核糖)聚合酶抑制劑(PARPi)耐藥的新機制。科學家們發現PARPi治療會引發染色質組蛋白釋放,而癌細胞要維持高速DNA復制就必須依賴組蛋白穩態機制。通過功能性遺傳篩選,研究團隊鑒定出組蛋白伴侶NASP的關鍵作用——其TPR模體能夠穩定被驅逐的組蛋白。

圖1 NASP通過調控組蛋白更新驅動PARP抑制劑耐藥性的產生
令人振奮的是,敲除NASP可使腫瘤細胞對PARPi處理產生超敏反應,這種現象在體外和體內實驗中都得到驗證。機制研究表明,NASP缺失會導致復制叉進展受阻,并顯著增加復制相關DNA損傷。更深入的分析顯示,NASP與INO80染色質重塑復合物以及PARP1的分子伴侶活性協同作用,共同確保組蛋白的高效周轉,從而避免致命性DNA損傷的累積。
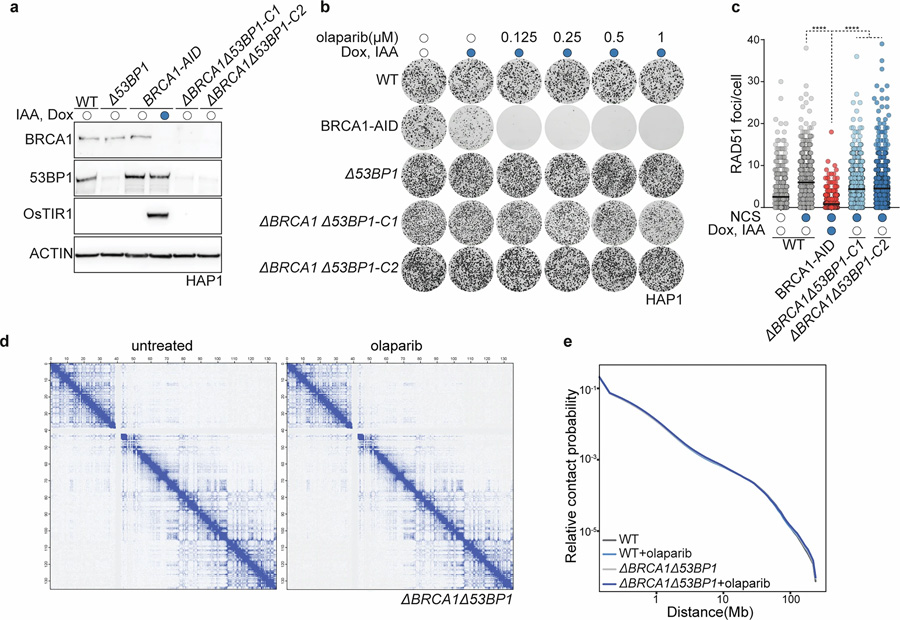
圖2 HAP1 delta-BRCA1delta-53BP1細胞具有PARP抑制劑耐藥性,且PARPi處理不改變整體染色質構象
這項研究首次報道了組蛋白驅逐是細胞對PARPi治療的即時響應,為通過靶向組蛋白供應通路來克服PARPi耐藥提供了極具前景的新策略。研究結果不僅深化了對PARPi作用機制的理解,更為開發新型聯合治療方案指明了方向。
參考資料
[1] NASP modulates histone turnover to drive PARP inhibitor resistance
摘要:研究人員發現靶向組蛋白伴侶NASP可增強PARPi敏感性。
PARP抑制劑(PARPi)在治療同源重組缺陷腫瘤中取得重大突破,但耐藥性仍是臨床挑戰。研究人員發現PARPi會觸發癌細胞染色質組蛋白釋放,而靶向組蛋白伴侶NASP可增強PARPi敏感性。該研究揭示了NASP通過TPR結構域維持組蛋白穩定性,與INO80復合物及PARP1協同調控組蛋白周轉,為克服PARPi耐藥提供了新靶點。
這項突破性研究揭示了聚(ADP-核糖)聚合酶抑制劑(PARPi)耐藥的新機制。科學家們發現PARPi治療會引發染色質組蛋白釋放,而癌細胞要維持高速DNA復制就必須依賴組蛋白穩態機制。通過功能性遺傳篩選,研究團隊鑒定出組蛋白伴侶NASP的關鍵作用——其TPR模體能夠穩定被驅逐的組蛋白。

圖1 NASP通過調控組蛋白更新驅動PARP抑制劑耐藥性的產生
令人振奮的是,敲除NASP可使腫瘤細胞對PARPi處理產生超敏反應,這種現象在體外和體內實驗中都得到驗證。機制研究表明,NASP缺失會導致復制叉進展受阻,并顯著增加復制相關DNA損傷。更深入的分析顯示,NASP與INO80染色質重塑復合物以及PARP1的分子伴侶活性協同作用,共同確保組蛋白的高效周轉,從而避免致命性DNA損傷的累積。

圖2 HAP1 delta-BRCA1delta-53BP1細胞具有PARP抑制劑耐藥性,且PARPi處理不改變整體染色質構象
這項研究首次報道了組蛋白驅逐是細胞對PARPi治療的即時響應,為通過靶向組蛋白供應通路來克服PARPi耐藥提供了極具前景的新策略。研究結果不僅深化了對PARPi作用機制的理解,更為開發新型聯合治療方案指明了方向。
參考資料
[1] NASP modulates histone turnover to drive PARP inhibitor resistance



