摘要:研究首次揭示了三陰性乳腺癌患者血漿中sEV攜帶的RTN4通過激活NF-κB信號通路促進EMT和PD-L1表達。
研究團隊通過分離非轉移性和轉移性三陰性乳腺癌(TNBC)患者血漿中的小細胞外囊泡(sEV),發現轉移組sEV中網狀蛋白4(RTN4)表達顯著升高。臨床數據分析顯示RTN4與晚期TNBC患者不良預后相關。體內外實驗證實,相比RTN4Low sEV,RTN4high sEV能顯著促進腫瘤細胞遷移、侵襲、上皮-間質轉化(EMT)和肺轉移,同時上調PD-L1表達并抑制CD8+T細胞浸潤。機制研究表明sEV-RTN4通過激活NF-κB信號通路驅動EMT和PD-L1表達。抗PD-1與抗RTN4聯合治療在抑制腫瘤轉移和促進免疫浸潤方面顯著優于單藥治療。

圖1 靶向sEVs內RTN4蛋白抑制三陰性乳腺癌轉移并增強免疫治療
1 Introduction
TNBC作為缺乏ER/PR/HER2表達的乳腺癌亞型,具有高度異質性和轉移傾向。盡管免疫檢查點阻斷(ICB)療法取得進展,但部分患者仍存在治療抵抗。sEV作為30-150nm的天然囊泡,在腫瘤微環境調控中發揮關鍵作用。既往研究發現RTN4在膠質瘤、肝癌等腫瘤中異常表達,但其在TNBC中的功能尚未闡明。
2 Methods
研究收集2018-2019年瑞金醫院TNBC患者血漿樣本,通過尺寸排阻色譜法分離sEV。采用冷凍電鏡(Cryo-TEM)和納米流式(NanoFCM)表征囊泡特征,4D標記定量蛋白質組學篩選差異蛋白。建立4T1原位瘤和尾靜脈轉移模型,通過免疫組化(IHC)、流式細胞術和染色質免疫沉淀(ChIP)等驗證機制。患者來源類器官(PDO)用于藥物敏感性測試。
3 Results
3.1 M-TNBC sEV促進腫瘤進展
轉移性TNBC患者血漿sEV(NM-sEV vs M-sEV)顯著增強MDA-MB-231細胞遷移侵襲能力(Transwell實驗顯示增加2.1倍)。小鼠模型中,M-sEV處理組肺轉移結節數增加3.5倍,腫瘤重量增加2.3倍,伴隨E-cadherin下調(0.4倍)和Vimentin上調(2.8倍)。
3.2 RTN4的臨床意義
蛋白質組學篩選出17個上調蛋白,其中RTN4在轉移組sEV中表達升高4.2倍。組織芯片分析顯示RTN4高表達患者5年生存率降低42%,且與CD8+T細胞減少(r=-0.67)和PD-L1升高(r=0.73)顯著相關。
3.3 RTN4的功能機制
shRNA敲低RTN4后,sEV促轉移效應減弱60%。RNA-seq揭示NF-κB通路關鍵基因(如RelA、IκBα)表達改變。PDTC抑制劑處理可逆轉RTN4high sEV誘導的EMT標志物變化,熒光素酶報告實驗證實p65直接調控PD-L1啟動子活性。
3.4 聯合治療價值
抗RTN4聯合抗PD-1使小鼠腫瘤體積縮小68%,肺轉移減少82%。PDO模型顯示聯合組CD8+T細胞浸潤增加3.1倍,E-cadherin表達恢復至對照組的1.8倍。納米流式動態監測顯示抗RTN4治療7天后血漿sEV-RTN4水平下降54%。
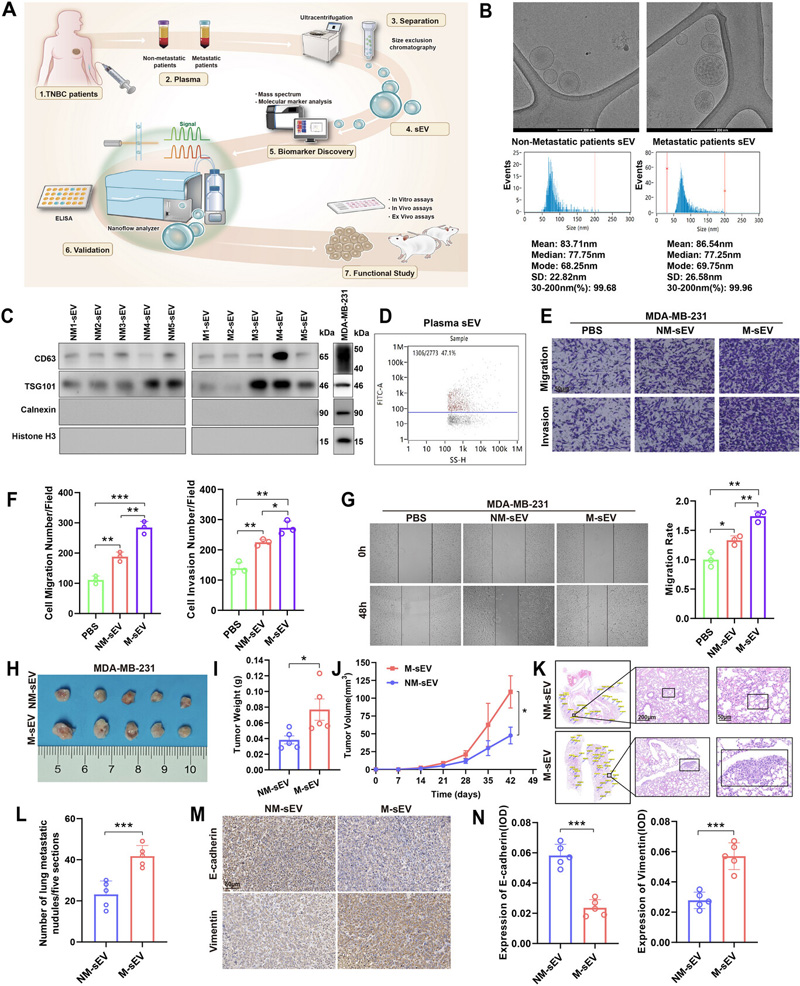
圖2 M-TNBC來源的sEV促進了TNBC的遷移、侵襲和轉移
4 Discussion
該研究創新性地將單顆粒檢測技術應用于sEV膜蛋白分析,闡明RTN4通過NF-κB/PD-L1軸驅動免疫逃逸的新機制。提出的"液體活檢+免疫聯合"策略為TNBC精準診療提供新思路,但sEV-RTN4的具體分泌調控機制仍需進一步探索。
Author Contributions
王涵與黃仁宏為共同第一作者,沈坤煒教授團隊主導完成從臨床樣本收集到機制研究的全流程工作,王正博士負責納米流式技術指導。研究獲得國家自然科學基金等項目支持。
參考資料
[1] Targeting Reticulin 4 (RTN4) Within Small Extracellular Vesicles Combats Metastasis and Reinforces Immunotherapy in Triple-Negative Breast Cancer
摘要:研究首次揭示了三陰性乳腺癌患者血漿中sEV攜帶的RTN4通過激活NF-κB信號通路促進EMT和PD-L1表達。
研究團隊通過分離非轉移性和轉移性三陰性乳腺癌(TNBC)患者血漿中的小細胞外囊泡(sEV),發現轉移組sEV中網狀蛋白4(RTN4)表達顯著升高。臨床數據分析顯示RTN4與晚期TNBC患者不良預后相關。體內外實驗證實,相比RTN4Low sEV,RTN4high sEV能顯著促進腫瘤細胞遷移、侵襲、上皮-間質轉化(EMT)和肺轉移,同時上調PD-L1表達并抑制CD8+T細胞浸潤。機制研究表明sEV-RTN4通過激活NF-κB信號通路驅動EMT和PD-L1表達。抗PD-1與抗RTN4聯合治療在抑制腫瘤轉移和促進免疫浸潤方面顯著優于單藥治療。

圖1 靶向sEVs內RTN4蛋白抑制三陰性乳腺癌轉移并增強免疫治療
1 Introduction
TNBC作為缺乏ER/PR/HER2表達的乳腺癌亞型,具有高度異質性和轉移傾向。盡管免疫檢查點阻斷(ICB)療法取得進展,但部分患者仍存在治療抵抗。sEV作為30-150nm的天然囊泡,在腫瘤微環境調控中發揮關鍵作用。既往研究發現RTN4在膠質瘤、肝癌等腫瘤中異常表達,但其在TNBC中的功能尚未闡明。
2 Methods
研究收集2018-2019年瑞金醫院TNBC患者血漿樣本,通過尺寸排阻色譜法分離sEV。采用冷凍電鏡(Cryo-TEM)和納米流式(NanoFCM)表征囊泡特征,4D標記定量蛋白質組學篩選差異蛋白。建立4T1原位瘤和尾靜脈轉移模型,通過免疫組化(IHC)、流式細胞術和染色質免疫沉淀(ChIP)等驗證機制。患者來源類器官(PDO)用于藥物敏感性測試。
3 Results
3.1 M-TNBC sEV促進腫瘤進展
轉移性TNBC患者血漿sEV(NM-sEV vs M-sEV)顯著增強MDA-MB-231細胞遷移侵襲能力(Transwell實驗顯示增加2.1倍)。小鼠模型中,M-sEV處理組肺轉移結節數增加3.5倍,腫瘤重量增加2.3倍,伴隨E-cadherin下調(0.4倍)和Vimentin上調(2.8倍)。
3.2 RTN4的臨床意義
蛋白質組學篩選出17個上調蛋白,其中RTN4在轉移組sEV中表達升高4.2倍。組織芯片分析顯示RTN4高表達患者5年生存率降低42%,且與CD8+T細胞減少(r=-0.67)和PD-L1升高(r=0.73)顯著相關。
3.3 RTN4的功能機制
shRNA敲低RTN4后,sEV促轉移效應減弱60%。RNA-seq揭示NF-κB通路關鍵基因(如RelA、IκBα)表達改變。PDTC抑制劑處理可逆轉RTN4high sEV誘導的EMT標志物變化,熒光素酶報告實驗證實p65直接調控PD-L1啟動子活性。
3.4 聯合治療價值
抗RTN4聯合抗PD-1使小鼠腫瘤體積縮小68%,肺轉移減少82%。PDO模型顯示聯合組CD8+T細胞浸潤增加3.1倍,E-cadherin表達恢復至對照組的1.8倍。納米流式動態監測顯示抗RTN4治療7天后血漿sEV-RTN4水平下降54%。

圖2 M-TNBC來源的sEV促進了TNBC的遷移、侵襲和轉移
4 Discussion
該研究創新性地將單顆粒檢測技術應用于sEV膜蛋白分析,闡明RTN4通過NF-κB/PD-L1軸驅動免疫逃逸的新機制。提出的"液體活檢+免疫聯合"策略為TNBC精準診療提供新思路,但sEV-RTN4的具體分泌調控機制仍需進一步探索。
Author Contributions
王涵與黃仁宏為共同第一作者,沈坤煒教授團隊主導完成從臨床樣本收集到機制研究的全流程工作,王正博士負責納米流式技術指導。研究獲得國家自然科學基金等項目支持。
參考資料
[1] Targeting Reticulin 4 (RTN4) Within Small Extracellular Vesicles Combats Metastasis and Reinforces Immunotherapy in Triple-Negative Breast Cancer



