摘要:研究首次證實靶向CTNNB1S37F驅動突變的TCR-T細胞能有效清除表達HLA-A02:01/HLA-A24:02的實體瘤。
HLA結合的復發(fā)驅動突變肽段是T細胞免疫治療的潛在靶點。研究發(fā)現CTNNB1S37F突變產生的兩種新抗原肽可被HLA-A02:01和HLA-A24:02遞呈,該突變導致β-catenin功能增強,美國每年新增病例超7,000例。從健康供體幼稚T細胞中分離出特異性TCR,轉導的T細胞在體外能有效殺傷CTNNB1S37F+細胞系和患者來源類器官,并在黑色素瘤細胞系和小鼠子宮內膜腺癌PDX模型中清除已形成的腫瘤。

圖1 靶向共享性β-連環(huán)蛋白突變的TCR工程化T細胞清除實體瘤
突變癌癥的流行率和發(fā)病率
分析MSK-MET研究25,775例樣本顯示,子宮內膜癌(3.35%)、宮頸癌(2.91%)和小腸癌(1.06%)中CTNNB1S37F突變頻率最高,美國年新增病例7,155例。結合HLA-A02:01(人群頻率35.48%)和HLA-A24:02(18.82%),理論可覆蓋3,885例患者。
新抗原肽的鑒定與定量
通過免疫肽組學在單等位基因B721.221細胞中鑒定出HLA-A02:01結合的10肽(YLDSGIHFGA)和HLA-A24:02結合的9肽(SYLDSGIHF)。靶向質譜顯示Mel888和Hutu80細胞表面分別呈現101和16個(HLA-A02:01)以及17和20個(HLA-A24:02)新抗原肽復合物,野生型肽幾乎未檢測到。新抗原肽-MHC復合物半衰期顯著長于野生型(HLA-A*02:01:7.3小時 vs 4.1小時)。
TCR篩選與功能驗證
從16名健康供體篩選獲得4個TCR(3個HLA-A02:01限制性,1個HLA-A24:02限制性)。TCRA2-2對肽的敏感性達499 pM,優(yōu)于臨床級TCR1G4(24.6 nM)。在重復殺傷實驗中,TCRA2-2能持續(xù)清除Hutu80A2細胞,而TCRA24對Mel888A24的EC50為227 pM。
體內治療效果
NXG小鼠模型中,TCRA2-2治療組8天內全部清除Mel888A24+A2黑色素瘤(n=7),隨訪115天僅1例復發(fā);子宮內膜癌PDX模型(n=7)中6例達到完全緩解。值得注意的是,復發(fā)腫瘤出現HLA-A02:01丟失但保留HLA-A24:02表達,提示免疫編輯機制差異。
臨床轉化潛力
與靶向KRASG12V(年適用16,593例)和TP53R175H(11,638例)相比,CTNNB1S37F適用人群規(guī)模較小,但針對目前缺乏有效靶向治療的Wnt/β-catenin通路。通過DRUP類試驗和HLA分型技術,可篩選適合接受該療法的患者。
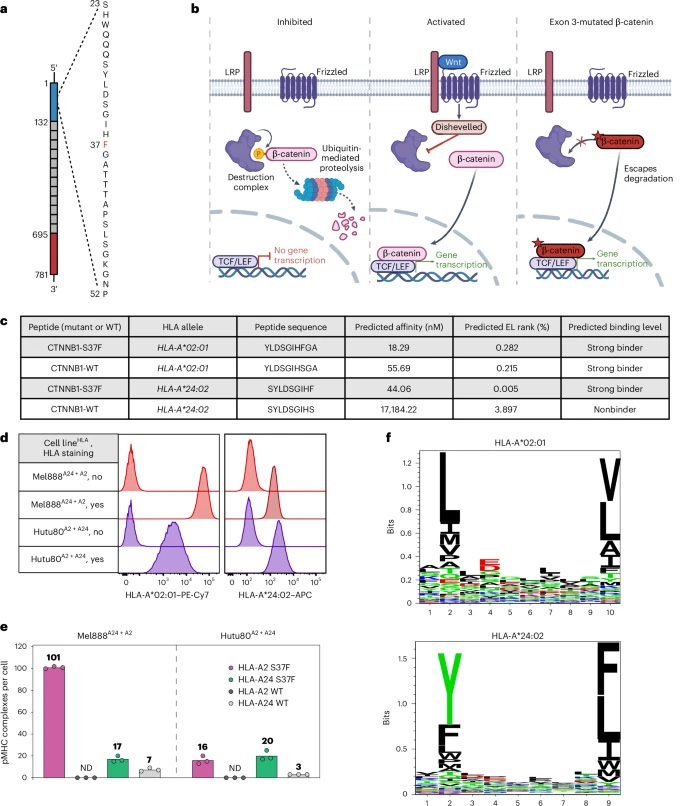
圖2 HLA-A2和HLA-A24分子呈遞的CTNNB1-S37F突變肽段的鑒定與定量分析
討論
該研究突破性地解決了β-catenin靶向治療的兩大難題:通過MS直接證實突變肽的遞呈,并利用健康供體TCR庫克服腫瘤誘導的免疫耐受。雖然突變/HLA組合頻率較低,但針對驅動突變的特點(如腫瘤早期出現、轉移灶保守表達)使其成為聯合治療的理想靶點。研究為開發(fā)靶向其他"不可成藥"癌基因的免疫療法提供了范式。
參考資料
[1] TCR-engineered T cells targeting a shared β-catenin mutation eradicate solid tumors
摘要:研究首次證實靶向CTNNB1S37F驅動突變的TCR-T細胞能有效清除表達HLA-A02:01/HLA-A24:02的實體瘤。
HLA結合的復發(fā)驅動突變肽段是T細胞免疫治療的潛在靶點。研究發(fā)現CTNNB1S37F突變產生的兩種新抗原肽可被HLA-A02:01和HLA-A24:02遞呈,該突變導致β-catenin功能增強,美國每年新增病例超7,000例。從健康供體幼稚T細胞中分離出特異性TCR,轉導的T細胞在體外能有效殺傷CTNNB1S37F+細胞系和患者來源類器官,并在黑色素瘤細胞系和小鼠子宮內膜腺癌PDX模型中清除已形成的腫瘤。

圖1 靶向共享性β-連環(huán)蛋白突變的TCR工程化T細胞清除實體瘤
突變癌癥的流行率和發(fā)病率
分析MSK-MET研究25,775例樣本顯示,子宮內膜癌(3.35%)、宮頸癌(2.91%)和小腸癌(1.06%)中CTNNB1S37F突變頻率最高,美國年新增病例7,155例。結合HLA-A02:01(人群頻率35.48%)和HLA-A24:02(18.82%),理論可覆蓋3,885例患者。
新抗原肽的鑒定與定量
通過免疫肽組學在單等位基因B721.221細胞中鑒定出HLA-A02:01結合的10肽(YLDSGIHFGA)和HLA-A24:02結合的9肽(SYLDSGIHF)。靶向質譜顯示Mel888和Hutu80細胞表面分別呈現101和16個(HLA-A02:01)以及17和20個(HLA-A24:02)新抗原肽復合物,野生型肽幾乎未檢測到。新抗原肽-MHC復合物半衰期顯著長于野生型(HLA-A*02:01:7.3小時 vs 4.1小時)。
TCR篩選與功能驗證
從16名健康供體篩選獲得4個TCR(3個HLA-A02:01限制性,1個HLA-A24:02限制性)。TCRA2-2對肽的敏感性達499 pM,優(yōu)于臨床級TCR1G4(24.6 nM)。在重復殺傷實驗中,TCRA2-2能持續(xù)清除Hutu80A2細胞,而TCRA24對Mel888A24的EC50為227 pM。
體內治療效果
NXG小鼠模型中,TCRA2-2治療組8天內全部清除Mel888A24+A2黑色素瘤(n=7),隨訪115天僅1例復發(fā);子宮內膜癌PDX模型(n=7)中6例達到完全緩解。值得注意的是,復發(fā)腫瘤出現HLA-A02:01丟失但保留HLA-A24:02表達,提示免疫編輯機制差異。
臨床轉化潛力
與靶向KRASG12V(年適用16,593例)和TP53R175H(11,638例)相比,CTNNB1S37F適用人群規(guī)模較小,但針對目前缺乏有效靶向治療的Wnt/β-catenin通路。通過DRUP類試驗和HLA分型技術,可篩選適合接受該療法的患者。

圖2 HLA-A2和HLA-A24分子呈遞的CTNNB1-S37F突變肽段的鑒定與定量分析
討論
該研究突破性地解決了β-catenin靶向治療的兩大難題:通過MS直接證實突變肽的遞呈,并利用健康供體TCR庫克服腫瘤誘導的免疫耐受。雖然突變/HLA組合頻率較低,但針對驅動突變的特點(如腫瘤早期出現、轉移灶保守表達)使其成為聯合治療的理想靶點。研究為開發(fā)靶向其他"不可成藥"癌基因的免疫療法提供了范式。
參考資料
[1] TCR-engineered T cells targeting a shared β-catenin mutation eradicate solid tumors



