摘要:研究團隊針對DNA病毒感染中天然免疫應答"靜默-激活"轉換的調控機制展開研究,發現SCF E3泛素連接酶復合物的底物識別組分FBXW7通過雙重調控機制。
當DNA病毒入侵時,環鳥苷酸-腺苷酸合成酶(cGAS)會識別病毒DNA,進而通過MITA(又稱STING)觸發I型干擾素(IFN-I)等細胞因子的產生。這些IFN-I進一步激活STAT1/2信號轉導,誘導干擾素刺激基因(ISGs)表達并啟動天然抗病毒反應。但科學家們一直困惑:未感染細胞如何維持免疫靜默狀態?感染后又如何快速激活應答?

圖1 FBXW7是DNA病毒引發的天然免疫應答的多功能調節因子
這項研究揭示了FBXW7——SCF E3泛素連接酶復合物的關鍵組分,在DNA病毒天然免疫中的精妙調控機制。在靜息狀態下,FBXW7通過雙重剎車機制:一方面在高爾基體降解被GSK3α/β磷酸化的轉運蛋白SLC35B2/3,減少硫酸化糖胺聚糖(sGAGs)的生成,使MITA保持休眠;另一方面清除GSK3α/β磷酸化的轉錄抑制因子MYC,確保STAT1/2維持在備戰水平。這種差異調控使細胞處于"箭在弦上"的警戒狀態。
當病毒來襲時,PI3K-AKT信號通路迅速激活,抑制GSK3α/β的活性。這直接解除了FBXW7對SLC35B2/3的降解作用,促使高爾基體大量產生sGAGs,進而激活MITA并啟動抗病毒應答。研究團隊在THP-1人源細胞和小鼠骨髓巨噬細胞(BMDM)中的基因敲除實驗完美驗證了這一調控機制。
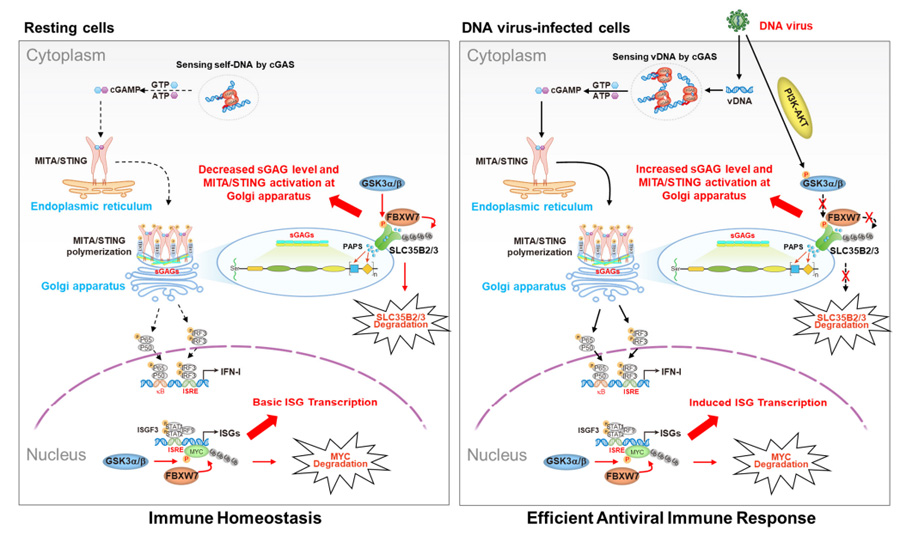
圖2 GSK3α/β-FBXW7分子軸調控MITA/STING蛋白活性及下游I型干擾素應答通路的作用機制模型
這項突破性發現首次闡明FBXW7如同精密的"免疫開關",通過差異調控I型干擾素環路的上游(MITA)和下游(STAT1/2)元件,實現天然免疫應答的精準時空調控,為抗DNA病毒治療提供了新的靶點策略。
參考資料
[1] FBXW7 is a multifaceted regulator of the innate immune response to DNA viruses
摘要:研究團隊針對DNA病毒感染中天然免疫應答"靜默-激活"轉換的調控機制展開研究,發現SCF E3泛素連接酶復合物的底物識別組分FBXW7通過雙重調控機制。
當DNA病毒入侵時,環鳥苷酸-腺苷酸合成酶(cGAS)會識別病毒DNA,進而通過MITA(又稱STING)觸發I型干擾素(IFN-I)等細胞因子的產生。這些IFN-I進一步激活STAT1/2信號轉導,誘導干擾素刺激基因(ISGs)表達并啟動天然抗病毒反應。但科學家們一直困惑:未感染細胞如何維持免疫靜默狀態?感染后又如何快速激活應答?

圖1 FBXW7是DNA病毒引發的天然免疫應答的多功能調節因子
這項研究揭示了FBXW7——SCF E3泛素連接酶復合物的關鍵組分,在DNA病毒天然免疫中的精妙調控機制。在靜息狀態下,FBXW7通過雙重剎車機制:一方面在高爾基體降解被GSK3α/β磷酸化的轉運蛋白SLC35B2/3,減少硫酸化糖胺聚糖(sGAGs)的生成,使MITA保持休眠;另一方面清除GSK3α/β磷酸化的轉錄抑制因子MYC,確保STAT1/2維持在備戰水平。這種差異調控使細胞處于"箭在弦上"的警戒狀態。
當病毒來襲時,PI3K-AKT信號通路迅速激活,抑制GSK3α/β的活性。這直接解除了FBXW7對SLC35B2/3的降解作用,促使高爾基體大量產生sGAGs,進而激活MITA并啟動抗病毒應答。研究團隊在THP-1人源細胞和小鼠骨髓巨噬細胞(BMDM)中的基因敲除實驗完美驗證了這一調控機制。

圖2 GSK3α/β-FBXW7分子軸調控MITA/STING蛋白活性及下游I型干擾素應答通路的作用機制模型
這項突破性發現首次闡明FBXW7如同精密的"免疫開關",通過差異調控I型干擾素環路的上游(MITA)和下游(STAT1/2)元件,實現天然免疫應答的精準時空調控,為抗DNA病毒治療提供了新的靶點策略。
參考資料
[1] FBXW7 is a multifaceted regulator of the innate immune response to DNA viruses



