摘要:研究發現轉錄因子MEF2C通過調控人類小膠質細胞的炎癥反應、吞噬功能及脂質代謝等關鍵通路。
本研究發現轉錄因子MEF2C通過調控人類小膠質細胞的炎癥反應、吞噬功能及脂質代謝等關鍵通路,在自閉癥譜系障礙(ASD)和神經退行性疾病中發揮核心作用。研究結合多組學分析和功能實驗,揭示了MEF2C缺失導致小膠質細胞功能紊亂的分子機制,為神經發育和衰老相關疾病的干預提供了新靶點。
MEF2C在人類小膠質細胞中的表達與發育調控
MEF2C(肌細胞增強因子2C)是一種在神經系統發育中至關重要的轉錄因子,其在人類小膠質細胞中的表達模式尚不明確。通過對胎兒和出生后人腦組織的轉錄組分析及免疫染色研究發現,MEF2C RNA在小膠質細胞中顯著富集,且幾乎所有的IBA1+小膠質細胞均表達MEF2C蛋白。胎兒階段小膠質細胞的MEF2C表達強度高于神經元,而出生后兩者表達水平趨于一致。這一結果提示MEF2C在早期妊娠階段對小膠質細胞的功能具有特別重要的作用。

圖1 MEF2C在人類小膠質細胞中的轉錄與表觀遺傳學靶點—對自閉癥風險及年齡相關疾病的細胞功能影響
CRISPR–Cas9編輯構建MEF2C缺陷型小膠質細胞模型
為深入研究MEF2C在小膠質細胞中的功能,研究團隊利用CRISPR–Cas9基因編輯技術,在誘導多能干細胞(iPS細胞)中構建了MEF2C單倍體不足(MHS)和完全敲除(KO)的等基因細胞系,并進一步將其分化為誘導小膠質細胞(iMG)。Western blot和免疫染色結果證實,MEF2C蛋白的表達呈劑量依賴性下降。形態學分析顯示,MEF2C缺失導致小膠質細胞分支長度和復雜性顯著降低,同時CD45表達上升、CX3CR1表達略有下降,表明MEF2C可能參與調控小膠質細胞的穩態維持。
MEF2C調控炎癥及疾病相關基因表達
RNA測序分析顯示,MEF2C-KO iMG中共有964個基因上調、606個基因下調。上調基因富集于免疫激活、吞噬體功能、溶酶體功能和脂質代謝等相關通路,而下調基因則與細胞黏附、突觸組織和淋巴細胞分化等功能相關。此外,MEF2C缺失還導致小膠質細胞穩態相關基因(如TMEM119和CX3CR1)表達下降。通過Ingenuity Pathway Analysis(IPA)預測,LPS和TNF可能是MEF2C缺失所致基因表達變化的上游調控因子。
MEF2C缺陷重現神經精神疾病的轉錄組特征
研究團隊進一步將MEF2C-KO iMG的差異表達基因與PsychEncode聯盟中的自閉癥(ASD)、雙相障礙(BD)和精神分裂癥(SCZ)腦轉錄組數據進行比較,發現MEF2C缺失所導致的上調基因與PsychEncode中的神經免疫模塊(如NF-κB、干擾素反應和染色質修飾酶相關模塊)高度重疊,這些模塊在ASD患者腦中同樣呈現上調狀態。這一結果提示,MEF2C缺失的小膠質細胞模型可較好地模擬ASD等神經精神疾病的分子表型。
網絡分析識別神經精神疾病相關基因模塊
通過加權基因共表達網絡分析(WGCNA),研究團隊發現兩個與MEF2C缺失高度正相關的基因模塊:模塊5(黃色模塊)和模塊4(淺青色模塊)。模塊5中的樞紐基因主要參與IFN/TGFβ信號、抗原呈遞和細胞因子信號等免疫相關通路,且與ASD、衰老小膠質細胞和阿爾茨海默病(AD)相關基因集顯著重疊;模塊4則富集于Toll樣受體(TLR)和干擾素基因信號通路,與ASD、LPS激活的小膠質細胞及AD相關基因集高度相關。這些模塊的識別為解析MEF2C調控小膠質細胞功能的機制提供了重要線索。
MEF2C缺失導致溶酶體相關功能異常
功能實驗證實,MEF2C-KO iMG表現出廣泛的吞噬功能受損,包括對酵母聚糖A和淀粉樣蛋白Aβ1–42的吞噬能力下降。此外,MEF2C缺失還引起溶酶體功能異常,表現為CD68蛋白表達上升、溶酶體質量增加(LysoTracker染色)以及LAMP1和LAMP2表達上調。這些結果表明,MEF2C缺失可能導致小膠質細胞中脂質積累和降解功能障礙,進而影響其免疫功能。
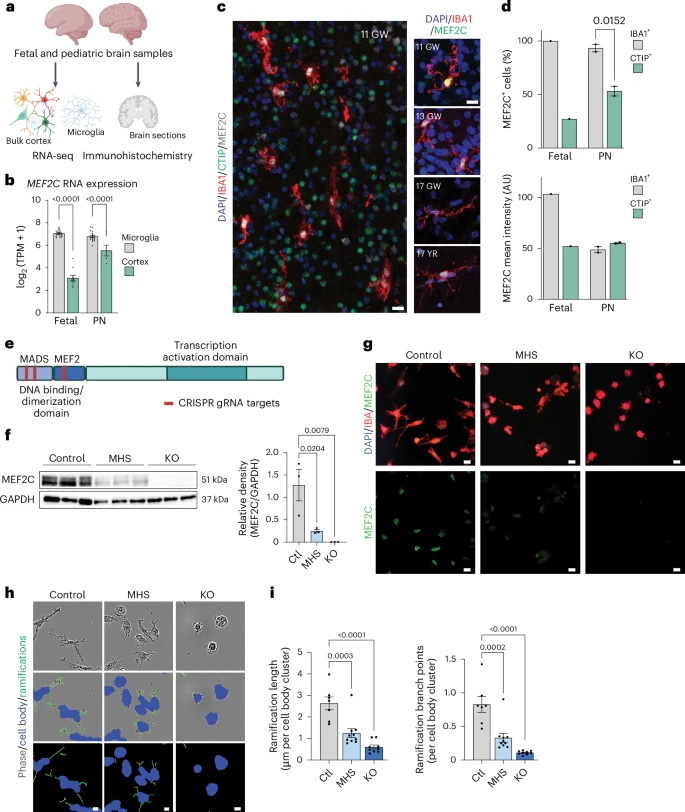
圖2 MEF2C在小膠質細胞的整個發育過程中均有表達,其功能缺失會引發表型改變
MEF2C缺失誘發高炎癥表型
在無炎癥刺激的情況下,MEF2C-KO iMG表現出誘導型一氧化氮合酶(iNOS)和活性氧(ROS)水平升高,且炎癥細胞因子(如IL-1β、IL-6、TNF和IL-8)的釋放增加。干擾素相關基因評分及STAT1磷酸化水平檢測進一步顯示,MEF2C缺失的小膠質細胞對IFNβ刺激的反應更為敏感,表明其處于一種“預激活”狀態,易于發生過度炎癥反應。
MEF2C缺失模擬神經退行性疾病相關表型
基因集富集分析顯示,MEF2C缺失所導致的差異表達基因與衰老小膠質細胞和AD相關基因集存在顯著重疊。實驗證實,MEF2C-KO iMG中β-半乳糖苷酶(β-gal)和APOE表達上升,而TREM2表達下降,同時細胞中脂滴積累(BODIPY染色)顯著增加。脂質組學分析進一步表明,KO iMG中磷脂、磷脂酰乙醇胺和磷脂酰膽堿等脂質類別顯著增多,這些脂質代謝異常與腦衰老及神經退行性疾病密切相關。
MEF2C調控活性增強子景觀
通過ATAC–seq和H3K27ac ChIP–seq分析,研究團隊發現MEF2C缺失導致超過8,000個增強子區域發生差異性乙酰化。 motif分析顯示,MEF2C結合位點富集于PU.1和MEF2C motif,且與AP-1、RUNX和CEBP等小膠質細胞譜系決定因子的結合位點共存。進一步將MEF2C結合位點與差異性乙酰化區域疊加,鑒定出MEF2C直接激活、直接抑制、間接激活和間接抑制四種調控類型,表明MEF2C在小膠質細胞中主要發揮轉錄激活作用,且可能通過與其他轉錄因子(如IRF、MITF)相互作用參與炎癥和溶酶體功能的調控。
MEF2C與自閉癥遺傳學的相關性
研究團隊還將自閉癥患者皮質組織中的差異性乙酰化增強子與細胞類型特異性增強子進行比對,發現這些增強子與小膠質細胞、神經元和少突膠質細胞特異性增強子均存在重疊。進一步分析顯示,與MEF2C-KO iMG中活性增強子相鄰的基因與自閉癥相關基因存在顯著重疊,提示MEF2C調控的增強子網絡在ASD發病機制中可能具有重要作用。
MEF2C在體內模型中重現體外表型
通過將人iPS細胞來源的造血祖細胞移植入免疫缺陷小鼠(CSF1h/hRag2-/-Il2rg-/-),研究團隊在體內驗證了MEF2C缺失對小膠質細胞形態和功能的影響。結果顯示,MEF2C-KO移植小膠質細胞(xMG)表現出阿米巴樣形態,分支點和連接數減少,溶酶體標志物CD68和脂滴相關蛋白PLIN2表達顯著上升,且電鏡觀察證實脂滴積累明顯。這些體內實驗結果與體外研究高度一致,進一步支持MEF2C在調節小膠質細胞穩態和功能中的關鍵作用。
討論與展望
本研究系統解析了MEF2C在人類小膠質細胞中的轉錄和表觀遺傳調控機制,揭示了其通過調節炎癥反應、吞噬功能、脂質代謝等關鍵通路參與ASD和神經退行性疾病的發生發展。盡管MEF2C在神經元中的功能已有較多研究,但其在小膠質細胞中的作用尚不明確。本研究不僅為理解MEF2C相關神經發育障礙的病理機制提供了新視角,也為針對小膠質細胞功能的治療策略提供了潛在靶點。未來研究可進一步探索MEF2C在不同神經疾病模型中的作用,以及其作為治療靶點的可行性。
參考資料
[1] Transcriptional and epigenetic targets of MEF2C in human microglia contribute to cellular functions related to autism risk and age-related disease
摘要:研究發現轉錄因子MEF2C通過調控人類小膠質細胞的炎癥反應、吞噬功能及脂質代謝等關鍵通路。
本研究發現轉錄因子MEF2C通過調控人類小膠質細胞的炎癥反應、吞噬功能及脂質代謝等關鍵通路,在自閉癥譜系障礙(ASD)和神經退行性疾病中發揮核心作用。研究結合多組學分析和功能實驗,揭示了MEF2C缺失導致小膠質細胞功能紊亂的分子機制,為神經發育和衰老相關疾病的干預提供了新靶點。
MEF2C在人類小膠質細胞中的表達與發育調控
MEF2C(肌細胞增強因子2C)是一種在神經系統發育中至關重要的轉錄因子,其在人類小膠質細胞中的表達模式尚不明確。通過對胎兒和出生后人腦組織的轉錄組分析及免疫染色研究發現,MEF2C RNA在小膠質細胞中顯著富集,且幾乎所有的IBA1+小膠質細胞均表達MEF2C蛋白。胎兒階段小膠質細胞的MEF2C表達強度高于神經元,而出生后兩者表達水平趨于一致。這一結果提示MEF2C在早期妊娠階段對小膠質細胞的功能具有特別重要的作用。

圖1 MEF2C在人類小膠質細胞中的轉錄與表觀遺傳學靶點—對自閉癥風險及年齡相關疾病的細胞功能影響
CRISPR–Cas9編輯構建MEF2C缺陷型小膠質細胞模型
為深入研究MEF2C在小膠質細胞中的功能,研究團隊利用CRISPR–Cas9基因編輯技術,在誘導多能干細胞(iPS細胞)中構建了MEF2C單倍體不足(MHS)和完全敲除(KO)的等基因細胞系,并進一步將其分化為誘導小膠質細胞(iMG)。Western blot和免疫染色結果證實,MEF2C蛋白的表達呈劑量依賴性下降。形態學分析顯示,MEF2C缺失導致小膠質細胞分支長度和復雜性顯著降低,同時CD45表達上升、CX3CR1表達略有下降,表明MEF2C可能參與調控小膠質細胞的穩態維持。
MEF2C調控炎癥及疾病相關基因表達
RNA測序分析顯示,MEF2C-KO iMG中共有964個基因上調、606個基因下調。上調基因富集于免疫激活、吞噬體功能、溶酶體功能和脂質代謝等相關通路,而下調基因則與細胞黏附、突觸組織和淋巴細胞分化等功能相關。此外,MEF2C缺失還導致小膠質細胞穩態相關基因(如TMEM119和CX3CR1)表達下降。通過Ingenuity Pathway Analysis(IPA)預測,LPS和TNF可能是MEF2C缺失所致基因表達變化的上游調控因子。
MEF2C缺陷重現神經精神疾病的轉錄組特征
研究團隊進一步將MEF2C-KO iMG的差異表達基因與PsychEncode聯盟中的自閉癥(ASD)、雙相障礙(BD)和精神分裂癥(SCZ)腦轉錄組數據進行比較,發現MEF2C缺失所導致的上調基因與PsychEncode中的神經免疫模塊(如NF-κB、干擾素反應和染色質修飾酶相關模塊)高度重疊,這些模塊在ASD患者腦中同樣呈現上調狀態。這一結果提示,MEF2C缺失的小膠質細胞模型可較好地模擬ASD等神經精神疾病的分子表型。
網絡分析識別神經精神疾病相關基因模塊
通過加權基因共表達網絡分析(WGCNA),研究團隊發現兩個與MEF2C缺失高度正相關的基因模塊:模塊5(黃色模塊)和模塊4(淺青色模塊)。模塊5中的樞紐基因主要參與IFN/TGFβ信號、抗原呈遞和細胞因子信號等免疫相關通路,且與ASD、衰老小膠質細胞和阿爾茨海默病(AD)相關基因集顯著重疊;模塊4則富集于Toll樣受體(TLR)和干擾素基因信號通路,與ASD、LPS激活的小膠質細胞及AD相關基因集高度相關。這些模塊的識別為解析MEF2C調控小膠質細胞功能的機制提供了重要線索。
MEF2C缺失導致溶酶體相關功能異常
功能實驗證實,MEF2C-KO iMG表現出廣泛的吞噬功能受損,包括對酵母聚糖A和淀粉樣蛋白Aβ1–42的吞噬能力下降。此外,MEF2C缺失還引起溶酶體功能異常,表現為CD68蛋白表達上升、溶酶體質量增加(LysoTracker染色)以及LAMP1和LAMP2表達上調。這些結果表明,MEF2C缺失可能導致小膠質細胞中脂質積累和降解功能障礙,進而影響其免疫功能。

圖2 MEF2C在小膠質細胞的整個發育過程中均有表達,其功能缺失會引發表型改變
MEF2C缺失誘發高炎癥表型
在無炎癥刺激的情況下,MEF2C-KO iMG表現出誘導型一氧化氮合酶(iNOS)和活性氧(ROS)水平升高,且炎癥細胞因子(如IL-1β、IL-6、TNF和IL-8)的釋放增加。干擾素相關基因評分及STAT1磷酸化水平檢測進一步顯示,MEF2C缺失的小膠質細胞對IFNβ刺激的反應更為敏感,表明其處于一種“預激活”狀態,易于發生過度炎癥反應。
MEF2C缺失模擬神經退行性疾病相關表型
基因集富集分析顯示,MEF2C缺失所導致的差異表達基因與衰老小膠質細胞和AD相關基因集存在顯著重疊。實驗證實,MEF2C-KO iMG中β-半乳糖苷酶(β-gal)和APOE表達上升,而TREM2表達下降,同時細胞中脂滴積累(BODIPY染色)顯著增加。脂質組學分析進一步表明,KO iMG中磷脂、磷脂酰乙醇胺和磷脂酰膽堿等脂質類別顯著增多,這些脂質代謝異常與腦衰老及神經退行性疾病密切相關。
MEF2C調控活性增強子景觀
通過ATAC–seq和H3K27ac ChIP–seq分析,研究團隊發現MEF2C缺失導致超過8,000個增強子區域發生差異性乙酰化。 motif分析顯示,MEF2C結合位點富集于PU.1和MEF2C motif,且與AP-1、RUNX和CEBP等小膠質細胞譜系決定因子的結合位點共存。進一步將MEF2C結合位點與差異性乙酰化區域疊加,鑒定出MEF2C直接激活、直接抑制、間接激活和間接抑制四種調控類型,表明MEF2C在小膠質細胞中主要發揮轉錄激活作用,且可能通過與其他轉錄因子(如IRF、MITF)相互作用參與炎癥和溶酶體功能的調控。
MEF2C與自閉癥遺傳學的相關性
研究團隊還將自閉癥患者皮質組織中的差異性乙酰化增強子與細胞類型特異性增強子進行比對,發現這些增強子與小膠質細胞、神經元和少突膠質細胞特異性增強子均存在重疊。進一步分析顯示,與MEF2C-KO iMG中活性增強子相鄰的基因與自閉癥相關基因存在顯著重疊,提示MEF2C調控的增強子網絡在ASD發病機制中可能具有重要作用。
MEF2C在體內模型中重現體外表型
通過將人iPS細胞來源的造血祖細胞移植入免疫缺陷小鼠(CSF1h/hRag2-/-Il2rg-/-),研究團隊在體內驗證了MEF2C缺失對小膠質細胞形態和功能的影響。結果顯示,MEF2C-KO移植小膠質細胞(xMG)表現出阿米巴樣形態,分支點和連接數減少,溶酶體標志物CD68和脂滴相關蛋白PLIN2表達顯著上升,且電鏡觀察證實脂滴積累明顯。這些體內實驗結果與體外研究高度一致,進一步支持MEF2C在調節小膠質細胞穩態和功能中的關鍵作用。
討論與展望
本研究系統解析了MEF2C在人類小膠質細胞中的轉錄和表觀遺傳調控機制,揭示了其通過調節炎癥反應、吞噬功能、脂質代謝等關鍵通路參與ASD和神經退行性疾病的發生發展。盡管MEF2C在神經元中的功能已有較多研究,但其在小膠質細胞中的作用尚不明確。本研究不僅為理解MEF2C相關神經發育障礙的病理機制提供了新視角,也為針對小膠質細胞功能的治療策略提供了潛在靶點。未來研究可進一步探索MEF2C在不同神經疾病模型中的作用,以及其作為治療靶點的可行性。
參考資料
[1] Transcriptional and epigenetic targets of MEF2C in human microglia contribute to cellular functions related to autism risk and age-related disease



