摘要:研究團隊對大型隊列的人類骨髓樣本進行了深入的分子和空間分析以揭示突變的HSC克隆如何獲得優勢。
每一秒,骨髓都會產生數百萬個新的血液細胞和免疫細胞。這種持續不斷的更新依賴于造血干細胞(HSC)、基質細胞和免疫調節因子之間精妙的合作。
隨著時間的推移,這種和諧關系被破壞。衰老、炎癥或體細胞突變會擾亂這些細胞之間的通訊,削弱干細胞更新能力,并允許突變的HSC擴增,最終導致不確定潛能的克隆性造血(CHIP)。
盡管CHIP本身無癥狀,但會使血液癌癥的風險增加十倍,心血管疾病和過早死亡的風險翻倍。骨髓增生異常綜合征(MDS)就是一種相關的HSC克隆性疾病。在70歲以上人群中,MDS的發病率為萬分之二,其中30%的病例會發展為急性髓系白血病(AML)。
盡管骨髓微環境具有重要的臨床意義,但人們對其促進這些血液疾病的機制仍知之甚少。

圖1 肥胖重塑脂肪組織中CD8+ T細胞的鐵代謝以加劇代謝性炎癥
為了揭示突變的HSC克隆如何獲得優勢,歐洲分子生物學實驗室(EMBL)和德國美因茨大學領導的研究團隊對大型隊列的人類骨髓樣本進行了深入的分子和空間分析,并將結果發表在《Nature Communications》雜志上。
觀察干細胞微環境
研究人員利用單細胞RNA測序、活檢成像、蛋白質組學等分析,構建了健康供者(包括CHIP患者)和MDS患者的骨髓微環境高分辨率圖譜。
這種綜合分析揭示了一種異常的細胞轉化,甚至在疾病出現之前就已經開始。研究人員發現了一群炎癥性基質細胞(iMSC),它們取代了正常的為干細胞提供支持的間充質基質細胞(MSC)。
與健康的基質細胞不同,這些炎癥性基質細胞會釋放大量干擾素誘導的細胞因子和趨化因子,吸引并激活干擾素響應性T細胞。這些T細胞反過來又會放大炎癥信號,形成一個前饋回路,維持慢性炎癥,抑制健康血液生成,并促進血管重塑。
探究骨髓炎癥的驅動因素
有趣的是,科學家們并未發現證據,說明MDS中突變的造血細胞本身驅動了炎癥。他們采用了一種名為SpliceUp的新型計算工具,該工具能夠區分單細胞數據中的突變細胞和非突變細胞。這更加凸顯了骨髓微環境在疾病進展中的重要性。
共同第一作者、EMBL的博士后研究員Karin Prummel表示:“令人驚訝的是,MDS階段的干細胞無法觸發基質細胞產生CXCL12,這是一種重要的信號分子,可引導血細胞在骨髓中定植。這種缺陷或許可以解釋骨髓為什么不再正常工作。”
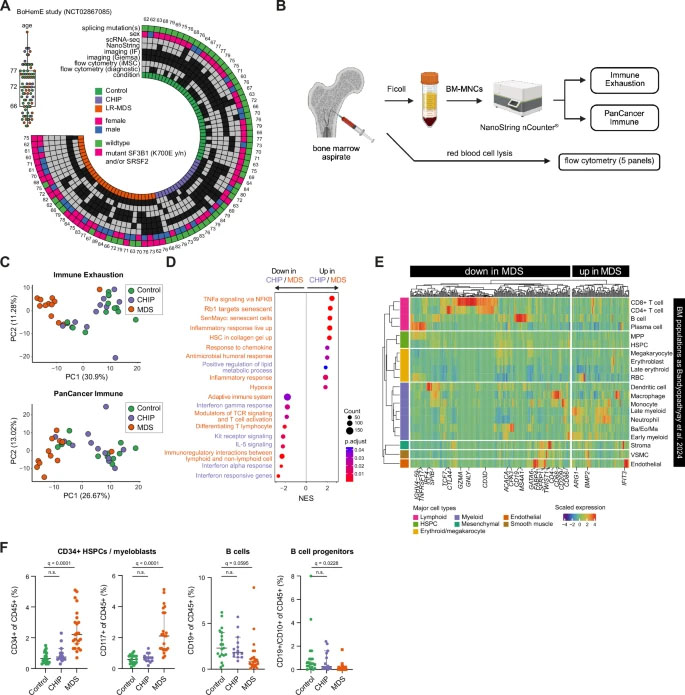
圖2 CHIP與MDS整體骨髓炎癥表達譜分析
研究人員認為炎癥是血液疾病早期階段的主要驅動力,并確定骨髓微環境為關鍵治療靶點。通過將研究重心從突變的干細胞轉向維持其存活的細胞生態系統,這項研究提出了新型的預防和治療策略。
抗炎藥物或干擾素調節劑可保護老年CHIP患者的骨髓功能,而靶向藥物與微環境療法的組合有望阻止疾病向MDS或AML進展。iMSC和干擾素響應性T細胞的分子特征還可以作為生物標志物,在臨床癥狀出現前識別高危人群。
共同通訊作者、美因茨大學的Borhane Guezguez指出:“我們的發現表明骨髓微環境主動塑造了惡性演化的早期階段。隨著分子圖譜分析技術的進步,我們能夠在臨床癥狀出現前數年檢測到白血病前期狀態。”
理解炎癥重塑機制
這項研究不僅拓展了血液學領域的認知,更加深了對炎癥性衰老(inflammaging)的理解。這種慢性的低度炎癥造成了多種年齡相關性疾病,包括癌癥、心血管疾病及代謝性疾病。
骨髓一度被認為是單純的造血器官,如今卻發現是炎癥性衰老的驅動因素和治療靶點。通過闡明免疫-基質相互作用如何促進疾病發展,這些發現為探究其他髓系惡性疾病中的炎癥重塑機制提供了框架。
參考資料
[1] Inflammatory stromal and T cells mediate human bone marrow niche remodeling in clonal hematopoiesis and myelodysplasia
摘要:研究團隊對大型隊列的人類骨髓樣本進行了深入的分子和空間分析以揭示突變的HSC克隆如何獲得優勢。
每一秒,骨髓都會產生數百萬個新的血液細胞和免疫細胞。這種持續不斷的更新依賴于造血干細胞(HSC)、基質細胞和免疫調節因子之間精妙的合作。
隨著時間的推移,這種和諧關系被破壞。衰老、炎癥或體細胞突變會擾亂這些細胞之間的通訊,削弱干細胞更新能力,并允許突變的HSC擴增,最終導致不確定潛能的克隆性造血(CHIP)。
盡管CHIP本身無癥狀,但會使血液癌癥的風險增加十倍,心血管疾病和過早死亡的風險翻倍。骨髓增生異常綜合征(MDS)就是一種相關的HSC克隆性疾病。在70歲以上人群中,MDS的發病率為萬分之二,其中30%的病例會發展為急性髓系白血病(AML)。
盡管骨髓微環境具有重要的臨床意義,但人們對其促進這些血液疾病的機制仍知之甚少。

圖1 肥胖重塑脂肪組織中CD8+ T細胞的鐵代謝以加劇代謝性炎癥
為了揭示突變的HSC克隆如何獲得優勢,歐洲分子生物學實驗室(EMBL)和德國美因茨大學領導的研究團隊對大型隊列的人類骨髓樣本進行了深入的分子和空間分析,并將結果發表在《Nature Communications》雜志上。
觀察干細胞微環境
研究人員利用單細胞RNA測序、活檢成像、蛋白質組學等分析,構建了健康供者(包括CHIP患者)和MDS患者的骨髓微環境高分辨率圖譜。
這種綜合分析揭示了一種異常的細胞轉化,甚至在疾病出現之前就已經開始。研究人員發現了一群炎癥性基質細胞(iMSC),它們取代了正常的為干細胞提供支持的間充質基質細胞(MSC)。
與健康的基質細胞不同,這些炎癥性基質細胞會釋放大量干擾素誘導的細胞因子和趨化因子,吸引并激活干擾素響應性T細胞。這些T細胞反過來又會放大炎癥信號,形成一個前饋回路,維持慢性炎癥,抑制健康血液生成,并促進血管重塑。
探究骨髓炎癥的驅動因素
有趣的是,科學家們并未發現證據,說明MDS中突變的造血細胞本身驅動了炎癥。他們采用了一種名為SpliceUp的新型計算工具,該工具能夠區分單細胞數據中的突變細胞和非突變細胞。這更加凸顯了骨髓微環境在疾病進展中的重要性。
共同第一作者、EMBL的博士后研究員Karin Prummel表示:“令人驚訝的是,MDS階段的干細胞無法觸發基質細胞產生CXCL12,這是一種重要的信號分子,可引導血細胞在骨髓中定植。這種缺陷或許可以解釋骨髓為什么不再正常工作。”

圖2 CHIP與MDS整體骨髓炎癥表達譜分析
研究人員認為炎癥是血液疾病早期階段的主要驅動力,并確定骨髓微環境為關鍵治療靶點。通過將研究重心從突變的干細胞轉向維持其存活的細胞生態系統,這項研究提出了新型的預防和治療策略。
抗炎藥物或干擾素調節劑可保護老年CHIP患者的骨髓功能,而靶向藥物與微環境療法的組合有望阻止疾病向MDS或AML進展。iMSC和干擾素響應性T細胞的分子特征還可以作為生物標志物,在臨床癥狀出現前識別高危人群。
共同通訊作者、美因茨大學的Borhane Guezguez指出:“我們的發現表明骨髓微環境主動塑造了惡性演化的早期階段。隨著分子圖譜分析技術的進步,我們能夠在臨床癥狀出現前數年檢測到白血病前期狀態。”
理解炎癥重塑機制
這項研究不僅拓展了血液學領域的認知,更加深了對炎癥性衰老(inflammaging)的理解。這種慢性的低度炎癥造成了多種年齡相關性疾病,包括癌癥、心血管疾病及代謝性疾病。
骨髓一度被認為是單純的造血器官,如今卻發現是炎癥性衰老的驅動因素和治療靶點。通過闡明免疫-基質相互作用如何促進疾病發展,這些發現為探究其他髓系惡性疾病中的炎癥重塑機制提供了框架。
參考資料
[1] Inflammatory stromal and T cells mediate human bone marrow niche remodeling in clonal hematopoiesis and myelodysplasia



