摘要:本研究首次系統性揭示了脊髓損傷(SCI)后誘發自主神經反射異常(AD)的完整神經元回路機制。
本研究首次系統性揭示了脊髓損傷(SCI)后誘發自主神經反射異常(AD)的完整神經元回路機制,發現Vsx2ON神經元群在胸腰段脊髓中的核心樞紐作用。通過硬膜外電刺激(EES)靶向血流動力學熱點可重構競爭性神經回路,顯著逆轉小鼠、大鼠及人類AD癥狀。該發現為開發基于神經回路的精準治療方案提供了理論依據。
自主神經反射異常(Autonomic Dysreflexia, AD)作為脊髓損傷(Spinal Cord Injury, SCI)后危及生命的嚴重并發癥,其特征為突發性高血壓發作,顯著增加心腦血管事件風險。本研究通過整合多尺度實驗技術,系統闡明了SCI后誘發AD的神經元架構機制,并開發出針對性的神經調控治療策略。

圖1 自主神經反射異常背后的神經元結構
空間組織特征
通過小鼠模型研究發現,結腸直腸擴張(Colorectal Distension)可誘發穩定重復的AD表型。全脊髓澄清技術與Fos蛋白標記顯示,AD激活神經元主要富集于兩個關鍵區域:接收腸道感覺傳入的腰骶段脊髓,以及調控血管運動的胸段"血流動力學熱點"區域。單核RNA測序(snRNA-seq)進一步揭示Vsx2ON興奮性神經元在AD過程中呈現最顯著的轉錄響應。
神經元架構解析
研究通過病毒追蹤與功能驗證手段,逐步重構出四級神經元回路:
1.背根神經節CalcaON傷害性神經元在SCI后形成異常投射至腰骶段脊髓
2.腰骶段SCLUMBAR::Vsx2投射神經元向胸段延伸異常軸突
3.胸段SCTHORACIC::Vsx2局部環路神經元接收異常傳入
4.膽堿能交感節前神經元(ChATON)最終介導血管收縮
化學遺傳學抑制任一節點均能有效阻斷AD發作,而光遺傳學激活則可直接誘發高血壓反應。
競爭性神經回路機制
研究發現硬膜外電刺激(Epidural Electrical Stimulation, EES)通過激活大直徑傳入纖維(PVON神經元)投射至SCTHORACIC::Vsx2神經元,形成與AD回路競爭性激活的良性調控通路。單神經元記錄證實同一Vsx2ON神經元可被AD刺激和EES共同調制。
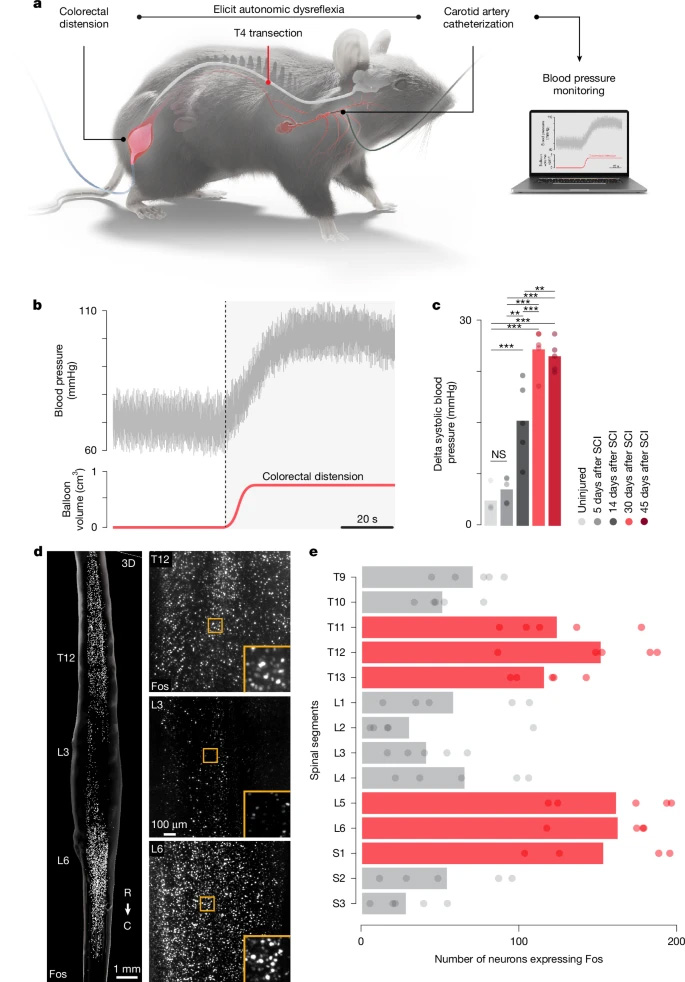
圖2 自主神經反射異常可觸發腰骶段及下胸段脊髓的轉錄活動
神經康復干預
每日EES靶向治療(自主神經康復)通過強化PVON-Vsx2ON突觸連接,同時削弱異常CalcaON-Vsx2ON投射,實現AD癥狀的長期逆轉。值得注意的是,錯誤靶向腰骶段的EES反而會加劇AD表型,凸顯靶點選擇的重要性。
臨床轉化價值
對1,733例SCI患者的調研顯示,82%四肢癱患者存在AD癥狀,其中僅30%接受治療且98%仍持續發作。初步臨床試驗證實,長期EES治療可顯著改善頭痛、心悸等血管性癥狀,為開發基于機制的精準醫療設備奠定了堅實基礎。
該研究不僅揭示了SCI后自主神經功能障礙的神經機制,更提供了通過神經調控技術重構競爭性神經回路的治療范式,為改善脊髓損傷患者生活質量提供了新途徑。
參考資料
[1] A neuronal architecture underlying autonomic dysreflexia
摘要:本研究首次系統性揭示了脊髓損傷(SCI)后誘發自主神經反射異常(AD)的完整神經元回路機制。
本研究首次系統性揭示了脊髓損傷(SCI)后誘發自主神經反射異常(AD)的完整神經元回路機制,發現Vsx2ON神經元群在胸腰段脊髓中的核心樞紐作用。通過硬膜外電刺激(EES)靶向血流動力學熱點可重構競爭性神經回路,顯著逆轉小鼠、大鼠及人類AD癥狀。該發現為開發基于神經回路的精準治療方案提供了理論依據。
自主神經反射異常(Autonomic Dysreflexia, AD)作為脊髓損傷(Spinal Cord Injury, SCI)后危及生命的嚴重并發癥,其特征為突發性高血壓發作,顯著增加心腦血管事件風險。本研究通過整合多尺度實驗技術,系統闡明了SCI后誘發AD的神經元架構機制,并開發出針對性的神經調控治療策略。

圖1 自主神經反射異常背后的神經元結構
空間組織特征
通過小鼠模型研究發現,結腸直腸擴張(Colorectal Distension)可誘發穩定重復的AD表型。全脊髓澄清技術與Fos蛋白標記顯示,AD激活神經元主要富集于兩個關鍵區域:接收腸道感覺傳入的腰骶段脊髓,以及調控血管運動的胸段"血流動力學熱點"區域。單核RNA測序(snRNA-seq)進一步揭示Vsx2ON興奮性神經元在AD過程中呈現最顯著的轉錄響應。
神經元架構解析
研究通過病毒追蹤與功能驗證手段,逐步重構出四級神經元回路:
1.背根神經節CalcaON傷害性神經元在SCI后形成異常投射至腰骶段脊髓
2.腰骶段SCLUMBAR::Vsx2投射神經元向胸段延伸異常軸突
3.胸段SCTHORACIC::Vsx2局部環路神經元接收異常傳入
4.膽堿能交感節前神經元(ChATON)最終介導血管收縮
化學遺傳學抑制任一節點均能有效阻斷AD發作,而光遺傳學激活則可直接誘發高血壓反應。
競爭性神經回路機制
研究發現硬膜外電刺激(Epidural Electrical Stimulation, EES)通過激活大直徑傳入纖維(PVON神經元)投射至SCTHORACIC::Vsx2神經元,形成與AD回路競爭性激活的良性調控通路。單神經元記錄證實同一Vsx2ON神經元可被AD刺激和EES共同調制。

圖2 自主神經反射異常可觸發腰骶段及下胸段脊髓的轉錄活動
神經康復干預
每日EES靶向治療(自主神經康復)通過強化PVON-Vsx2ON突觸連接,同時削弱異常CalcaON-Vsx2ON投射,實現AD癥狀的長期逆轉。值得注意的是,錯誤靶向腰骶段的EES反而會加劇AD表型,凸顯靶點選擇的重要性。
臨床轉化價值
對1,733例SCI患者的調研顯示,82%四肢癱患者存在AD癥狀,其中僅30%接受治療且98%仍持續發作。初步臨床試驗證實,長期EES治療可顯著改善頭痛、心悸等血管性癥狀,為開發基于機制的精準醫療設備奠定了堅實基礎。
該研究不僅揭示了SCI后自主神經功能障礙的神經機制,更提供了通過神經調控技術重構競爭性神經回路的治療范式,為改善脊髓損傷患者生活質量提供了新途徑。
參考資料
[1] A neuronal architecture underlying autonomic dysreflexia



