摘要:本研究揭示了組蛋白H3K9乳酸化(H3K9la)通過轉錄調控NFATc2表達促進纖維樣滑膜細胞(FLSs)遷移侵襲的新機制。
類風濕關節炎(Rheumatoid Arthritis, RA)是一種以慢性滑膜炎、自身抗體產生和關節骨破壞為特征的自身免疫性疾病。在RA患者的關節微環境中,缺氧和代謝重編程導致乳酸大量積累,形成高乳酸微環境。雖然既往研究提示乳酸可能參與RA進展,但其具體分子機制始終不明。近年來,乳酸被發現在腫瘤免疫等領域作為信號分子發揮重要調控作用,特別是組蛋白乳酸化作為一種新型蛋白質翻譯后修飾,在多種疾病中被證實具有基因轉錄調控功能。然而,組蛋白乳酸化是否在RA發病過程中發揮作用,以及是否參與自身抗體的產生,仍有待深入探索。
溫州醫科大學研究團隊在《Nature Communications》發表的最新研究,首次系統揭示了組蛋白乳酸化修飾在RA疾病進展中的關鍵作用。研究人員通過整合多組學分析、分子生物學實驗和動物模型驗證,闡明了乳酸依賴性組蛋白修飾調控纖維樣滑膜細胞(Fibroblast-like Synoviocytes, FLSs)致病性的新機制,并為RA診斷提供了新型血清學標志物。

圖1 組蛋白乳酸化通過增加NFATc2表達及抗乳酸化組蛋白自身抗體產生促進類風濕關節炎進展
研究采用的主要技術方法包括:Western blot和免疫熒光檢測組蛋白乳酸化水平;CUT & Tag技術(切割標簽技術)聯合RNA測序篩選H3K9la靶基因;染色質免疫沉淀(ChIP-qPCR)驗證組蛋白修飾與基因啟動子結合;利用膠原誘導性關節炎(CIA)和膠原抗體誘導性關節炎(CAIA)小鼠模型進行體內功能驗證;ELISA檢測血清自身抗體水平。所有人類樣本均來源于未經疾病修飾抗風濕藥(DMARDs)治療的新診斷RA患者。
研究結果
組蛋白H3K9乳酸化在RA患者滑膜組織中顯著升高
研究人員首先發現RA患者FLSs中全局乳酸化水平顯著高于健康對照(HC)和痛風性關節炎(GA)患者,且乳酸化蛋白富集于分子量15kDa的核內蛋白。通過pH對照實驗排除酸性環境干擾,證實乳酸鈉和乳酸處理均可特異性增強FLSs的乳酸化修飾。進一步針對8個已知組蛋白乳酸化位點的檢測顯示,H3K9la在RA患者FLSs和滑膜組織中表達顯著上調,且乳酸處理可明顯促進H3K9la水平。
NFATc2被篩選確認為H3K9la的關鍵靶基因
通過CUT & Tag技術分析發現,H3K9la在RA-FLSs中更多富集于基因啟動子區域,且結合基序與HC存在差異(RA中為"GKACTGTA",HC中為"SKGTATAC")。KEGG通路分析顯示H3K9la結合基因顯著富集于"類風濕關節炎"通路。整合RNA-seq數據篩選出68個同時存在H3K9la高結合且表達上調的靶基因,其中7個基因與"細胞運動性"功能相關。進一步篩選發現NFATc2和IL12A啟動子區域存在H3K9la結合基序,且NFATc2表達差異最顯著。ChIP-qPCR證實H3K9la在NFATc2啟動子區域高度富集,RT-qPCR驗證NFATc2在RA-FLSs中表達上調。
NFATc2過表達通過增強FLS遷移侵襲促進RA進展
實驗證實NFATc2在RA患者FLSs和滑膜組織中表達升高,且去磷酸化活化和核轉位增強。通過shRNA敲低NFATc2表達后,RA-FLSs的遷移侵襲能力顯著減弱。在SCID小鼠共植入模型中,敲低NFATc2的RA-FLSs軟骨侵蝕能力降低。在CIA小鼠模型中,關節內注射LV-shNFATc2慢病毒可減輕關節腫脹和組織病理評分。FLS特異性NFATc2敲除小鼠在CAIA模型中關節炎癥狀明顯改善。RNA-seq分析顯示,敲低NFATc2后MMP9、MMP13和IL-6等軟骨破壞和炎癥相關基因表達下調。
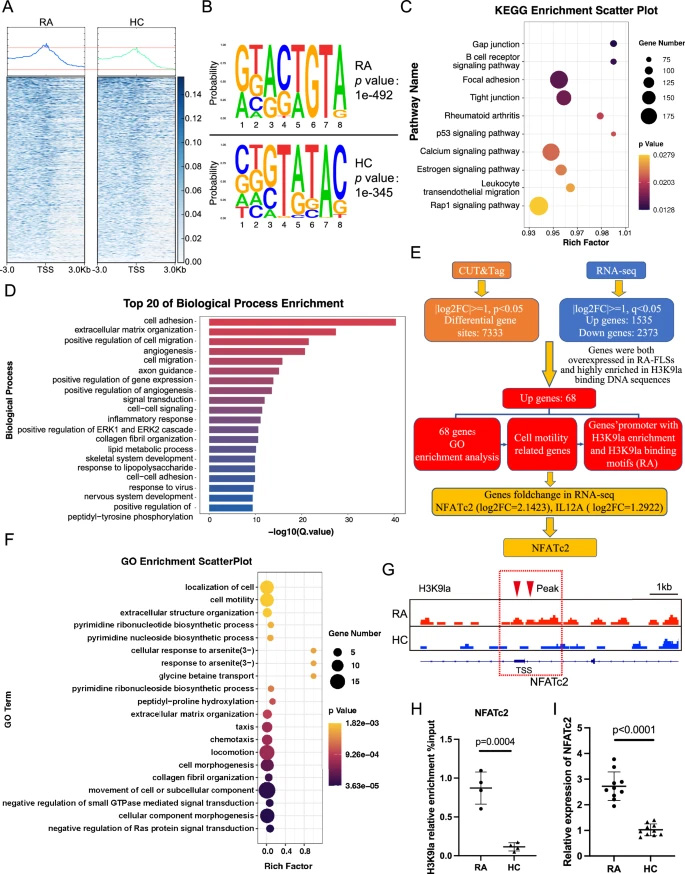
圖2 運用CUT & Tag與RNA-seq技術篩選H3K9乳酸化修飾在類風濕關節炎成纖維樣滑膜細胞中調控的靶基因
乳酸依賴性H3K9la增強NFATc2表達
通過干擾乳酸脫氫酶(LDH)表達或活性(使用抑制劑FX-11),細胞內乳酸產生減少導致H3K9la水平下降,NFATc2表達降低,RA-FLSs遷移侵襲能力減弱。另一方面,細胞外乳酸通過單羧酸轉運蛋白1(MCT1)進入細胞,乳酸干預可增加H3K9la水平和NFATc2表達,促進FLS遷移和細胞因子分泌,而MCT1抑制劑AZD-3965可阻斷這些效應。
靶向H3K9la減輕CIA小鼠關節炎進展
在CIA小鼠模型中,FX-11或AZD-3965處理組關節腫脹程度較輕,關節炎評分較低,軟骨破壞改善,組織學評分降低。免疫熒光顯示FX-11或AZD-3965治療降低了滑膜組織中H3K9la水平和NFATc2表達。同時,治療組血清中促炎細胞因子(TNF-α、IL-6、IL-1β)濃度降低,抗炎細胞因子IL-10濃度升高。與甲氨蝶呤(MTX)聯合治療后,關節炎癥狀進一步改善。
RA患者血清中存在特異性識別乳酸化組蛋白的自身抗體
研究發現RA患者血清中存在抗乳酸化組蛋白自身抗體,包括抗H2B、H3和H4乳酸化抗體。ELISA檢測顯示RA患者抗乳酸化組蛋白自身抗體水平顯著高于HC和銀屑病關節炎(PsA)患者,其中抗H3K9la抗體與DAS28評分呈正相關,且在高活動度RA患者中水平更高??笻3K9la抗體在血清陽性和血清陰性RA患者中均存在,與抗CCP抗體水平無相關性。
研究結論與意義
本研究首次系統揭示了組蛋白乳酸化修飾在RA發病機制中的關鍵作用:RA關節高乳酸微環境通過促進組蛋白H3K9乳酸化修飾,轉錄上調NFATc2表達,增強FLSs的遷移侵襲能力,從而推動關節炎進展。同時發現的抗乳酸化組蛋白自身抗體為RA診斷提供了新的血清學標志物。
該研究的重要意義在于:從表觀遺傳學角度揭示了乳酸代謝物在RA中的新型調控機制;鑒定NFATc2作為H3K9la的下游關鍵效應分子,為RA治療提供了潛在靶點;發現抗乳酸化組蛋白自身抗體與疾病活動度的相關性,為RA診斷和病情評估提供了新指標;通過抑制乳酸產生(FX-11)和攝取(AZD-3965)可減輕關節炎癥狀,為RA治療提供了新的策略思路。
這項研究不僅深化了對RA發病機制的理解,也為開發針對代謝-表觀遺傳軸的新型治療方法和診斷工具奠定了重要基礎,具有顯著的臨床轉化潛力。
參考資料
[1] Histone lactylation promotes rheumatoid arthritis progression by increasing NFATc2 expression and the production of anti-lactylated histone autoantibodies
摘要:本研究揭示了組蛋白H3K9乳酸化(H3K9la)通過轉錄調控NFATc2表達促進纖維樣滑膜細胞(FLSs)遷移侵襲的新機制。
類風濕關節炎(Rheumatoid Arthritis, RA)是一種以慢性滑膜炎、自身抗體產生和關節骨破壞為特征的自身免疫性疾病。在RA患者的關節微環境中,缺氧和代謝重編程導致乳酸大量積累,形成高乳酸微環境。雖然既往研究提示乳酸可能參與RA進展,但其具體分子機制始終不明。近年來,乳酸被發現在腫瘤免疫等領域作為信號分子發揮重要調控作用,特別是組蛋白乳酸化作為一種新型蛋白質翻譯后修飾,在多種疾病中被證實具有基因轉錄調控功能。然而,組蛋白乳酸化是否在RA發病過程中發揮作用,以及是否參與自身抗體的產生,仍有待深入探索。
溫州醫科大學研究團隊在《Nature Communications》發表的最新研究,首次系統揭示了組蛋白乳酸化修飾在RA疾病進展中的關鍵作用。研究人員通過整合多組學分析、分子生物學實驗和動物模型驗證,闡明了乳酸依賴性組蛋白修飾調控纖維樣滑膜細胞(Fibroblast-like Synoviocytes, FLSs)致病性的新機制,并為RA診斷提供了新型血清學標志物。

圖1 組蛋白乳酸化通過增加NFATc2表達及抗乳酸化組蛋白自身抗體產生促進類風濕關節炎進展
研究采用的主要技術方法包括:Western blot和免疫熒光檢測組蛋白乳酸化水平;CUT&Tag技術(切割標簽技術)聯合RNA測序篩選H3K9la靶基因;染色質免疫沉淀(ChIP-qPCR)驗證組蛋白修飾與基因啟動子結合;利用膠原誘導性關節炎(CIA)和膠原抗體誘導性關節炎(CAIA)小鼠模型進行體內功能驗證;ELISA檢測血清自身抗體水平。所有人類樣本均來源于未經疾病修飾抗風濕藥(DMARDs)治療的新診斷RA患者。
研究結果
組蛋白H3K9乳酸化在RA患者滑膜組織中顯著升高
研究人員首先發現RA患者FLSs中全局乳酸化水平顯著高于健康對照(HC)和痛風性關節炎(GA)患者,且乳酸化蛋白富集于分子量15kDa的核內蛋白。通過pH對照實驗排除酸性環境干擾,證實乳酸鈉和乳酸處理均可特異性增強FLSs的乳酸化修飾。進一步針對8個已知組蛋白乳酸化位點的檢測顯示,H3K9la在RA患者FLSs和滑膜組織中表達顯著上調,且乳酸處理可明顯促進H3K9la水平。
NFATc2被篩選確認為H3K9la的關鍵靶基因
通過CUT&Tag技術分析發現,H3K9la在RA-FLSs中更多富集于基因啟動子區域,且結合基序與HC存在差異(RA中為"GKACTGTA",HC中為"SKGTATAC")。KEGG通路分析顯示H3K9la結合基因顯著富集于"類風濕關節炎"通路。整合RNA-seq數據篩選出68個同時存在H3K9la高結合且表達上調的靶基因,其中7個基因與"細胞運動性"功能相關。進一步篩選發現NFATc2和IL12A啟動子區域存在H3K9la結合基序,且NFATc2表達差異最顯著。ChIP-qPCR證實H3K9la在NFATc2啟動子區域高度富集,RT-qPCR驗證NFATc2在RA-FLSs中表達上調。
NFATc2過表達通過增強FLS遷移侵襲促進RA進展
實驗證實NFATc2在RA患者FLSs和滑膜組織中表達升高,且去磷酸化活化和核轉位增強。通過shRNA敲低NFATc2表達后,RA-FLSs的遷移侵襲能力顯著減弱。在SCID小鼠共植入模型中,敲低NFATc2的RA-FLSs軟骨侵蝕能力降低。在CIA小鼠模型中,關節內注射LV-shNFATc2慢病毒可減輕關節腫脹和組織病理評分。FLS特異性NFATc2敲除小鼠在CAIA模型中關節炎癥狀明顯改善。RNA-seq分析顯示,敲低NFATc2后MMP9、MMP13和IL-6等軟骨破壞和炎癥相關基因表達下調。

圖2 運用CUT & Tag與RNA-seq技術篩選H3K9乳酸化修飾在類風濕關節炎成纖維樣滑膜細胞中調控的靶基因
乳酸依賴性H3K9la增強NFATc2表達
通過干擾乳酸脫氫酶(LDH)表達或活性(使用抑制劑FX-11),細胞內乳酸產生減少導致H3K9la水平下降,NFATc2表達降低,RA-FLSs遷移侵襲能力減弱。另一方面,細胞外乳酸通過單羧酸轉運蛋白1(MCT1)進入細胞,乳酸干預可增加H3K9la水平和NFATc2表達,促進FLS遷移和細胞因子分泌,而MCT1抑制劑AZD-3965可阻斷這些效應。
靶向H3K9la減輕CIA小鼠關節炎進展
在CIA小鼠模型中,FX-11或AZD-3965處理組關節腫脹程度較輕,關節炎評分較低,軟骨破壞改善,組織學評分降低。免疫熒光顯示FX-11或AZD-3965治療降低了滑膜組織中H3K9la水平和NFATc2表達。同時,治療組血清中促炎細胞因子(TNF-α、IL-6、IL-1β)濃度降低,抗炎細胞因子IL-10濃度升高。與甲氨蝶呤(MTX)聯合治療后,關節炎癥狀進一步改善。
RA患者血清中存在特異性識別乳酸化組蛋白的自身抗體
研究發現RA患者血清中存在抗乳酸化組蛋白自身抗體,包括抗H2B、H3和H4乳酸化抗體。ELISA檢測顯示RA患者抗乳酸化組蛋白自身抗體水平顯著高于HC和銀屑病關節炎(PsA)患者,其中抗H3K9la抗體與DAS28評分呈正相關,且在高活動度RA患者中水平更高。抗H3K9la抗體在血清陽性和血清陰性RA患者中均存在,與抗CCP抗體水平無相關性。
研究結論與意義
本研究首次系統揭示了組蛋白乳酸化修飾在RA發病機制中的關鍵作用:RA關節高乳酸微環境通過促進組蛋白H3K9乳酸化修飾,轉錄上調NFATc2表達,增強FLSs的遷移侵襲能力,從而推動關節炎進展。同時發現的抗乳酸化組蛋白自身抗體為RA診斷提供了新的血清學標志物。
該研究的重要意義在于:從表觀遺傳學角度揭示了乳酸代謝物在RA中的新型調控機制;鑒定NFATc2作為H3K9la的下游關鍵效應分子,為RA治療提供了潛在靶點;發現抗乳酸化組蛋白自身抗體與疾病活動度的相關性,為RA診斷和病情評估提供了新指標;通過抑制乳酸產生(FX-11)和攝?。ˋZD-3965)可減輕關節炎癥狀,為RA治療提供了新的策略思路。
這項研究不僅深化了對RA發病機制的理解,也為開發針對代謝-表觀遺傳軸的新型治療方法和診斷工具奠定了重要基礎,具有顯著的臨床轉化潛力。
參考資料
[1] Histone lactylation promotes rheumatoid arthritis progression by increasing NFATc2 expression and the production of anti-lactylated histone autoantibodies



