摘要:科學家們采用人工智能、冷凍電鏡和遺傳學技術,以前所未有的細節揭示了細胞如何協調和保護核糖體小亞基的生成。
核糖體是細胞內的蛋白質工廠,它讀取遺傳密碼并組裝生物體生存所需的蛋白質。然而,對于核糖體本身是如何形成的,我們卻知之甚少。
如今,科學家們首次動態捕捉到這一過程的關鍵環節。他們采用人工智能、冷凍電鏡和遺傳學技術,以前所未有的細節揭示了細胞如何協調和保護核糖體小亞基的生成。這項成果于10月29日發表在《Nature》雜志上。
通訊作者、洛克菲勒大學的Sebastian Klinge教授表示:“我們終于獲得了核糖體形成的分子電影——現在能夠了解各個環節是如何連接的?!?/div>
圖1 解旋酶介導的小亞基加工體成熟與解聚機制

圖1 解旋酶介導的小亞基加工體成熟與解聚機制
構建核糖體
十多年來,Klinge實驗室一直試圖回答分子生物學中最基本的問題之一:細胞如何構建核糖體。核糖體對生命至關重要,每個細胞都投入大量能量來制造它們。然而,組裝數千個分子部件的過程極其復雜且轉瞬即逝,難以捕捉。
研究人員深知,核糖體小亞基(SSU)的前體必須經歷一系列復雜的重塑和質量控制步驟,才能成為負責解碼基因并最終產生蛋白質的核糖體亞基,但調控這些轉變的機制卻難以捉摸。
快照顯示,一定存在某種因素確保SSU的形成途徑始終向前推進,而不會逆轉;先前的研究表明,兩種解旋酶Mtr4(參與RNA降解)和Dhr1(組裝因子之一)正在協調這一過程。但這些是如何協同運作的,仍然是個謎。
第一作者Olga Buzovetsky表示:“長期以來,我們對這個領域的了解僅限于一些蛋白質會離開,一些蛋白質會加入。但我們不知道為什么會這樣,也不知道是如何發生的?!?/div>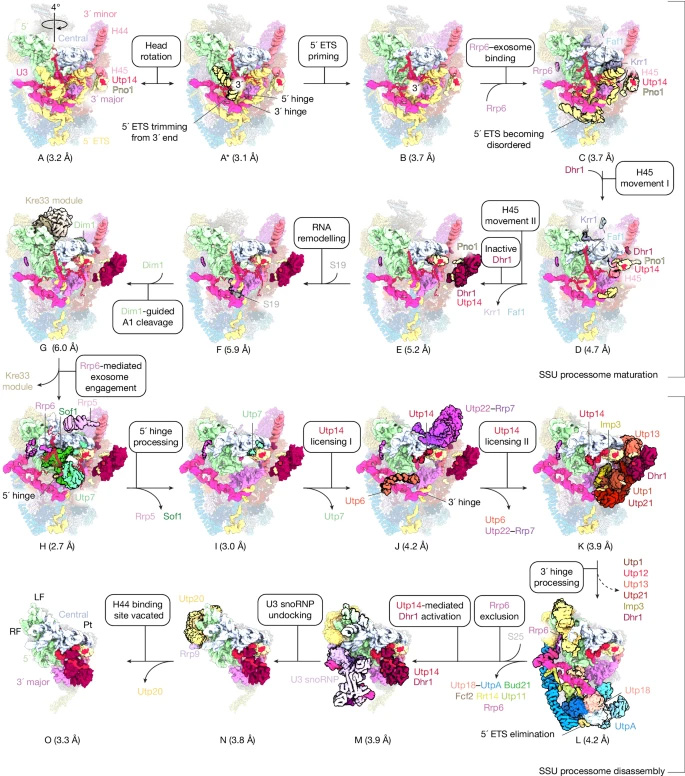
圖2 小亞基加工體的成熟與解聚通路
圖1 解旋酶介導的小亞基加工體成熟與解聚機制
分子電影
為了填補這一缺口,研究團隊將人工智能、結構生物學和遺傳學結合起來,采用了一種以計算為起點的方法。他們利用AlphaFold工具對構成核糖體的分子間3500多種潛在相互作用進行建模。這些預測結果如同路線圖,幫助研究人員確定哪些相互作用需要在實驗室中進行測試。
在這些結果的指引下,他們改造了酵母細胞,以便標記和追蹤關鍵的組裝蛋白。利用冷凍電鏡技術,他們采集了超過20萬張快照,并重建了16種不同的三維結構,完整呈現了核糖體小亞基組裝的每一個步驟。

圖2 小亞基加工體的成熟與解聚通路
“這是我們首篇真正建立在AI基礎上的論文,” Klinge說。“我們沒有像以往那樣通過遺傳學和生物化學方法解析結構,而是直接從人工智能入手,利用其結構預測結果來設計遺傳學和生物化學實驗。因此,AI加速了初步發現,讓我們能夠建立可檢驗的假設?!?/div>
最終呈現的是一部近乎連續的“分子電影”,生動展現了這臺關鍵機器的形成過程。在十六個階段中,研究人員觀察到Mtr4酶就像分子馬達一樣,通過分解RNA來推動整個進程。這個不可逆步驟引發了重組和蛋白質釋放的連鎖反應,讓組裝過程始終朝著單一方向推進。
影片還揭示了Utp14蛋白的關鍵作用——這種柔性蛋白通過定位并激活解旋酶Dhr1,成為核心協調者。當Dhr1進入活性狀態后,會解開并移除RNA伴侶蛋白,完成最終組裝步驟。
研究還揭示了一套精密的保障機制:RNA外切體在整個組裝過程中始終與核糖體亞基保持連接,實時監控組裝進度。當組裝接近尾聲時,這些連接逐漸松動,外切體隨即切換至質量控制模式,逐個檢查已完成的顆粒,確保功能完備的核糖體才能進入下一階段。
這些結果標志著科學與技術的雙重里程碑?!拔覀儾辉僦皇桥臄z核糖體形成的各個關鍵階段的快照,” Buzovetsky指出。“相反,我們能夠理解RNA和蛋白質在核糖體合成的全過程中如何相互作用和彼此對話。”
下一步,實驗室計劃運用AI驅動的模型,將研究延伸至核糖體組裝的更早期階段,以及防止錯誤產生的質量控制系統。“憑借現有的工具,我們能夠達到所需的分辨率,從而更深入地理解這些過程,” Buzovetsky表示。
參考資料
[1] Helicase-mediated mechanism of SSU processome maturation and disassembly
摘要:科學家們采用人工智能、冷凍電鏡和遺傳學技術,以前所未有的細節揭示了細胞如何協調和保護核糖體小亞基的生成。
核糖體是細胞內的蛋白質工廠,它讀取遺傳密碼并組裝生物體生存所需的蛋白質。然而,對于核糖體本身是如何形成的,我們卻知之甚少。
如今,科學家們首次動態捕捉到這一過程的關鍵環節。他們采用人工智能、冷凍電鏡和遺傳學技術,以前所未有的細節揭示了細胞如何協調和保護核糖體小亞基的生成。這項成果于10月29日發表在《Nature》雜志上。
通訊作者、洛克菲勒大學的Sebastian Klinge教授表示:“我們終于獲得了核糖體形成的分子電影——現在能夠了解各個環節是如何連接的。”

圖1 解旋酶介導的小亞基加工體成熟與解聚機制
構建核糖體
十多年來,Klinge實驗室一直試圖回答分子生物學中最基本的問題之一:細胞如何構建核糖體。核糖體對生命至關重要,每個細胞都投入大量能量來制造它們。然而,組裝數千個分子部件的過程極其復雜且轉瞬即逝,難以捕捉。
研究人員深知,核糖體小亞基(SSU)的前體必須經歷一系列復雜的重塑和質量控制步驟,才能成為負責解碼基因并最終產生蛋白質的核糖體亞基,但調控這些轉變的機制卻難以捉摸。
快照顯示,一定存在某種因素確保SSU的形成途徑始終向前推進,而不會逆轉;先前的研究表明,兩種解旋酶Mtr4(參與RNA降解)和Dhr1(組裝因子之一)正在協調這一過程。但這些是如何協同運作的,仍然是個謎。
第一作者Olga Buzovetsky表示:“長期以來,我們對這個領域的了解僅限于一些蛋白質會離開,一些蛋白質會加入。但我們不知道為什么會這樣,也不知道是如何發生的?!?/div>
圖2 小亞基加工體的成熟與解聚通路
分子電影
為了填補這一缺口,研究團隊將人工智能、結構生物學和遺傳學結合起來,采用了一種以計算為起點的方法。他們利用AlphaFold工具對構成核糖體的分子間3500多種潛在相互作用進行建模。這些預測結果如同路線圖,幫助研究人員確定哪些相互作用需要在實驗室中進行測試。
在這些結果的指引下,他們改造了酵母細胞,以便標記和追蹤關鍵的組裝蛋白。利用冷凍電鏡技術,他們采集了超過20萬張快照,并重建了16種不同的三維結構,完整呈現了核糖體小亞基組裝的每一個步驟。

圖2 小亞基加工體的成熟與解聚通路
“這是我們首篇真正建立在AI基礎上的論文,” Klinge說?!拔覀儧]有像以往那樣通過遺傳學和生物化學方法解析結構,而是直接從人工智能入手,利用其結構預測結果來設計遺傳學和生物化學實驗。因此,AI加速了初步發現,讓我們能夠建立可檢驗的假設。”
最終呈現的是一部近乎連續的“分子電影”,生動展現了這臺關鍵機器的形成過程。在十六個階段中,研究人員觀察到Mtr4酶就像分子馬達一樣,通過分解RNA來推動整個進程。這個不可逆步驟引發了重組和蛋白質釋放的連鎖反應,讓組裝過程始終朝著單一方向推進。
影片還揭示了Utp14蛋白的關鍵作用——這種柔性蛋白通過定位并激活解旋酶Dhr1,成為核心協調者。當Dhr1進入活性狀態后,會解開并移除RNA伴侶蛋白,完成最終組裝步驟。
研究還揭示了一套精密的保障機制:RNA外切體在整個組裝過程中始終與核糖體亞基保持連接,實時監控組裝進度。當組裝接近尾聲時,這些連接逐漸松動,外切體隨即切換至質量控制模式,逐個檢查已完成的顆粒,確保功能完備的核糖體才能進入下一階段。
這些結果標志著科學與技術的雙重里程碑?!拔覀儾辉僦皇桥臄z核糖體形成的各個關鍵階段的快照,” Buzovetsky指出?!跋喾?,我們能夠理解RNA和蛋白質在核糖體合成的全過程中如何相互作用和彼此對話?!?/div>
下一步,實驗室計劃運用AI驅動的模型,將研究延伸至核糖體組裝的更早期階段,以及防止錯誤產生的質量控制系統?!皯{借現有的工具,我們能夠達到所需的分辨率,從而更深入地理解這些過程,” Buzovetsky表示。
參考資料
[1] Helicase-mediated mechanism of SSU processome maturation and disassembly



