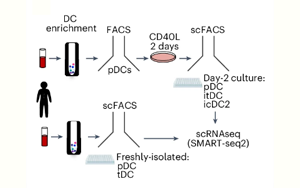
研究揭示了漿細(xì)胞樣樹突狀細(xì)胞(pDC)在腫瘤壞死因子(TNF)和I型干擾素(IFN-I)動態(tài)平衡調(diào)控下,通過表觀遺傳重編程轉(zhuǎn)化為傳統(tǒng)樹突狀細(xì)胞樣(cDC2-like)的分子機(jī)制。研究通過克隆分化實驗(單細(xì)胞培養(yǎng))證實轉(zhuǎn)化是pDC的固有屬性,排除了前體細(xì)胞污染的爭議。然而,轉(zhuǎn)化效率存在個體差異(約30-50%),可能與TNFR1表達(dá)異質(zhì)性有關(guān)。
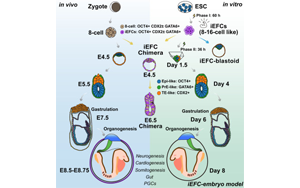
化學(xué)誘導(dǎo)胚胎祖細(xì)胞實現(xiàn)小鼠胚胎發(fā)育全周期高保真體外模型構(gòu)建
廣州國家實驗室的研究人員通過精心設(shè)計的小分子化合物組合,成功將小鼠胚胎干細(xì)胞(ESCs)直接重編程為具有多能性的8-16細(xì)胞樣胚胎祖細(xì)胞(iEFCs)。這些誘導(dǎo)獲得的胚胎祖細(xì)胞展現(xiàn)出驚人的發(fā)育潛力,能夠自主形成包含所有囊胚譜系的胚胎模型(iEFC-EM),并首次在體外完整重現(xiàn)了從初始細(xì)胞命運決定到器官發(fā)生的全過程。這項突破性研究成果發(fā)表在頂級期刊《Cell》上。

環(huán)狀RNA適配體靶向IGF2BP2克服BET抑制劑獲得性耐藥:三陰性乳腺癌治療新策略
研究人員通過系統(tǒng)分析發(fā)現(xiàn),耐藥TNBC細(xì)胞中circRNA BISC表達(dá)顯著降低,而RNA結(jié)合蛋白IGF2BP2異常激活。進(jìn)一步研究揭示,BISC含有獨特的"CAC-|9-12|-XGGX"基序,能特異性結(jié)合IGF2BP2的KH3/KH4結(jié)構(gòu)域,從而競爭性阻斷IGF2BP2與c-MYC mRNA的相互作用。
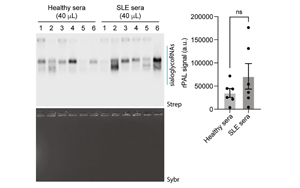
RNA N-糖基化通過免疫逃逸和穩(wěn)態(tài)胞葬作用維持免疫平衡的分子機(jī)制
來自國際團(tuán)隊的研究人員揭示了RNA N-糖基化(glycoRNA)通過修飾acp3U堿基屏蔽先天免疫識別的新機(jī)制。該研究證實glycoRNA的N-糖鏈能阻止Toll樣受體3/7(TLR3/7)對內(nèi)源性小RNA的識別,并促進(jìn)凋亡細(xì)胞的非炎癥性清除。這一發(fā)現(xiàn)為自身免疫疾病治療提供了新靶點DTWD2-acp3U通路。
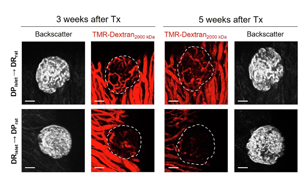
胰島微環(huán)境影響1型糖尿病發(fā)展的機(jī)制研究:基于BioBreeding大鼠模型及apoCIII靶向干預(yù)策略
研究人員創(chuàng)新性地利用BioBreeding(BB)大鼠模型,通過眼前房移植技術(shù)結(jié)合多模態(tài)成像,首次在活體水平揭示了糖尿病前期微環(huán)境對胰島功能的決定性影響。研究發(fā)現(xiàn)載脂蛋白CIII(apoCIII)作為關(guān)鍵介質(zhì),通過激活炎癥小體和促炎因子IL-1β,驅(qū)動了移植胰島的血管退化和β細(xì)胞凋亡。
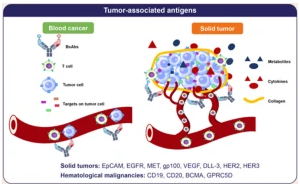
雙特異性抗體:開啟腫瘤治療新時代
綜述全面闡述了雙特異性抗體(BsAbs)在腫瘤治療中的革命性進(jìn)展,重點分析了其結(jié)構(gòu)設(shè)計(如IgG樣/非IgG樣)、作用機(jī)制(橋接型/抗原交聯(lián)型/輔因子模擬型)及17種已獲批BsAbs的臨床數(shù)據(jù)。
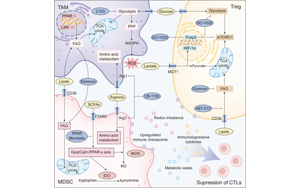
免疫細(xì)胞重編程中的代謝檢查點:通過免疫代謝重定向?qū)崿F(xiàn)癌癥治療
免疫細(xì)胞代謝在調(diào)節(jié)細(xì)胞增殖、分化和功能反應(yīng)中發(fā)揮著關(guān)鍵作用,共同塑造著腫瘤微環(huán)境(TME)內(nèi)的免疫應(yīng)答。 近期的研究進(jìn)展日益凸顯了免疫細(xì)胞多樣化的代謝表型及其與腫瘤動態(tài)之間復(fù)雜的相互作用。免疫細(xì)胞代謝展現(xiàn)出顯著的可塑性,使得代謝網(wǎng)絡(luò)能夠根據(jù)外部刺激精確地調(diào)控免疫細(xì)胞的行為。此外,在免疫代謝學(xué)研究中,代謝特征與免疫細(xì)胞命運、活化狀態(tài)及功能之間的強關(guān)聯(lián)性已被反復(fù)闡明。因此,靶向被稱為“代謝檢查點”的代謝網(wǎng)絡(luò),以重編程免疫細(xì)胞表型并增強抗腫瘤免疫力,為臨床轉(zhuǎn)化帶來了重大希望。
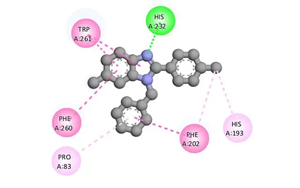
組蛋白去乙酰化酶6通過去乙酰化與泛素化修飾ATG3調(diào)控自噬的新機(jī)制
來自國內(nèi)的研究人員針對ATG3蛋白在自噬中的調(diào)控機(jī)制這一科學(xué)問題,揭示了HDAC6通過雙重修飾(去乙酰化與K272位泛素化)調(diào)控ATG3降解的新途徑。該研究闡明了HDAC6兼具去乙酰化酶和E3泛素連接酶活性的獨特功能,為自噬相關(guān)疾病治療提供了新靶點。
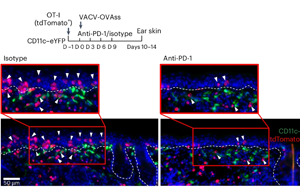
PD-1通過TGFβ信號通路調(diào)控皮膚組織駐留記憶T細(xì)胞(TRM)形成與功能分化的機(jī)制研究
Weill Cornell Medicine(美國威爾康奈爾醫(yī)學(xué)院)的研究團(tuán)隊通過系統(tǒng)的實驗設(shè)計,揭示了PD-1通過TGFβ信號通路調(diào)控皮膚TRM形成的新機(jī)制。研究發(fā)現(xiàn),PD-1不僅在慢性感染導(dǎo)致的T細(xì)胞耗竭中起作用,更是TRM早期命運決定的關(guān)鍵調(diào)控因子。這一發(fā)現(xiàn)為理解PD-1抑制劑的雙重作用——既增強抗腫瘤免疫又引發(fā)皮膚毒性——提供了分子基礎(chǔ),相關(guān)成果發(fā)表在《Nature Immunology》上。